はじめに
終末糖化産物=Advanced Glycation End Products(AGEs)は、タンパク質、脂質、核酸が非酵素的に糖化・酸化されることによって生成される多様な分子群です。 AGEsは、細胞内および細胞外マトリックスのタンパク質を架橋し、細胞表面受容体であるRAGE(Receptor for AGEs)に結合することで、複数の細胞プロセスを調節し、組織の機能や機械的特性を変化させることが知られています。 特に、糖尿病などの高血糖状態ではAGEsの生成と蓄積が亢進し、心血管疾患の発症と進展に重要な役割を果たすと考えられています。 本稿では、AGEsの生成機構、心血管疾患におけるAGEsの役割、そしてAGEsを標的とした治療法の可能性について解説します。
AGEs生成のメカニズム
メイラード反応( Maillard reaction)
AGEsは、メイラード反応( Maillard reaction)と呼ばれる非酵素的な糖化・酸化プロセスを経て生成されます。 この反応は、グルコースなどの還元糖のカルボニル基と、タンパク質、脂質、核酸のアミノ基との間で起こります。
- シッフ塩基の生成: 最初のステップとして、還元糖とアミノ基が反応し、不安定なシッフ塩基が生成されます。 この反応は数時間以内に可逆的に起こります。
- アマドリ転位:数日〜数週間かけて、シッフ塩基はより安定なアマドリ化合物へと転位します。
- AGEsの生成: 数ヶ月から数年かけて、アマドリ化合物は酸化、脱水などのさらなる構造変化を受け、最終的に安定なAGEsへと変化します。 この過程で、メチルグリオキサールや3-デオキシグルコソンなどの反応性の高いジカルボニル化合物が生成されます。 これらはAGEsの主要な前駆体であり、特にN-カルボキシメチルリシン(CML)は体内で最も豊富なAGEsの一つで、高い抗原性を示します。
代表的なAGEs
AGEsには多様な構造がありますが、代表的なものとして以下が挙げられます。
- CML(カルボキシメチルリシン)
- ペントシジン
- クロスライン
- Glyoxal Lysine Dimer(GOLD)
これらの化合物は、架橋型と非架橋型に分かれ、特に架橋型AGEは組織の剛性を高め、動脈硬化や心筋線維化を促進する原因となります。
AGEsと心血管疾患
糖尿病と心血管リスク
糖尿病における心血管合併症は、糖尿病患者の死亡原因の65%を占め、インスリン治療を受けている糖尿病患者の33%が50歳までに心血管疾患で死亡すると報告されています。フラミンガム研究によると、45-74歳の糖尿病患者では、男性で2.4倍、女性で5倍、心不全の発症リスクが高まります。このリスクは、年齢、肥満、高血圧、高脂血症、冠動脈疾患などの既知の危険因子とは独立しています。
AGEsと糖尿病
AGEsは、加齢に伴い自然に体内に蓄積するだけでなく、糖尿病患者ではその蓄積速度が著しく亢進します。 実際、糖尿病患者の血清AGEsレベルは、非糖尿病者の約1.8倍に達するという報告もあります(糖尿病患者:7.4 U/mL、非糖尿病者:4.2 U/mL)。 また、別の研究では、糖尿病性腎症患者の動脈壁コラーゲン中のAGEs量は、非糖尿病者の約4倍にも達することが示されています(糖尿病患者:14.5 ± 5.2 U/mg、非糖尿病者:3.6 ± 1.5 AGE U/mg)。
これらのAGEsは、心血管系に多岐にわたる影響を及ぼし、冠動脈疾患、心不全、動脈硬化などの病態に関与します。
冠動脈疾患(CHD)
AGEsは、冠動脈の粥腫病変に蓄積し、糖尿病患者におけるアテローム性動脈硬化の進展を加速させます。 実際、冠動脈疾患を有する2型糖尿病患者の血清AGEsレベルは、CHDを合併していない糖尿病患者よりも有意に高いことが報告されています(CHD合併糖尿病患者:8.1 U/mL、CHD非合併糖尿病患者:7.1 U/mL)。 さらに、経皮的冠動脈インターベンション(PCI)後の再狭窄のリスク因子となることも示唆されています。
糖尿病性心不全
糖尿病は、心不全の独立した危険因子であり、糖尿病患者は非糖尿病患者に比べて2~4倍も心不全を発症しやすいことがフラミンガム研究で示されています。 AGEsは、血管への影響(冠動脈機能不全、アテローム性動脈硬化、血栓症)と心筋への直接的な作用の両方を介して、糖尿病患者における心不全の発症と進展を加速させます。
- 血管への影響: AGEsは、血管内皮細胞、平滑筋細胞、単球上のRAGEに結合し、炎症、アテローム形成、血管収縮を引き起こし、冠動脈機能不全、アテローム性動脈硬化、血栓症を促進します。
- 心筋への直接的な影響: AGEsは、心筋細胞外基質タンパク質を架橋し、心筋細胞上のRAGEを介して、心筋の収縮能と拡張能の両方に悪影響を及ぼします。
プラズマペントシジンレベル(架橋型AGEsの一種)は、脳性ナトリウム利尿ペプチド(BNP)、年齢、腎機能、NYHA機能クラスなどの既知の危険因子とは独立して、心不全患者の再入院と死亡率を予測する因子です。同様に、N-CML(糖尿病患者の血清で最も普遍的な抗原性AGEsの一つ)の血漿レベルは、NYHA機能クラスと相関し、収縮性心不全患者の転帰を予測します。
その他の大血管疾患
AGEsは、頸動脈狭窄や末梢動脈閉塞性疾患などの他の大血管病変とも関連があります。 AGEsの血中濃度は、末梢動脈疾患や頸動脈プラークの存在や厚さ(IMT)と相関しています。
AGEsとアテローム性動脈硬化(Atherosclerosis)
AGEsは動脈硬化の進展に深く関与しており、以下のような病態メカニズムが示されています:
- 内皮機能障害:AGEsが血管内皮細胞のNO合成を抑制し、血管拡張能を低下させます。
- 酸化LDLの促進:AGE-modified LDLはマクロファージにより容易に取り込まれ、泡沫細胞を形成しやすく、プラーク形成を助長します。
- 平滑筋細胞の遊走・増殖:AGEsとRAGEの結合により、血管平滑筋細胞の遊走と増殖が促進され、プラークの不安定化を引き起こす可能性があります。
- 炎症性サイトカインの誘導:NF-κB活性化により、TNF-αやIL-6、ICAM-1、VCAM-1が誘導され、血管壁の慢性炎症状態が持続します。
AGEsと血管の硬化(Aortic Stiffness)
- AGEsによってコラーゲンやエラスチンが架橋されると、血管壁の弾力性が失われ、血管のスティフネス(硬化)が進行します。
- 論文では、脈圧(Pulse Pressure)がAGEの蓄積と相関することが報告されています。脈圧の上昇は大動脈の硬化度の指標であり、高齢者や糖尿病患者で特に顕著です。
可溶型RAGE(sRAGE)の役割
可溶型RAGE(sRAGE, esRAGE)は、AGEsと結合して膜型RAGEへの結合を競合的に抑制し、大血管への有害シグナルを遮断する保護因子として作用する可能性があります。
sRAGEの低下が動脈硬化性疾患のマーカーとなりうる可能性が示唆されています。
AGEsと糖尿病合併症
AGEsは、糖尿病の細小血管合併症および大血管合併症の発症と進展の両方に関与します。
糖尿病性腎症
1型糖尿病患者を対象とした研究では、皮膚コラーゲン中のAGEsレベルと、糖尿病性腎症を含む細小血管合併症の進行との間に相関関係が認められています。 2型糖尿病患者においても、皮膚AGEsは、腎症を含む細小血管合併症の強力な独立予測因子であることが示されています。 糖尿病患者の腎臓は、AGEsの蓄積部位であると同時に、AGEsの主要なクリアランス器官でもあります。 糖尿病性腎症モデル動物では、糸球体基底膜の肥厚、糸球体硬化、メサンギウムの拡大、尿細管間質の線維化など、腎臓の構造的変化が認められており、これらの変化にAGEsが関与している可能性が示唆されています。
糖尿病性網膜症
2型糖尿病患者の網膜血管には、AGEs、特にCMLが蓄積することが報告されています。 また、AGEsレベルは、網膜症の重症度と相関することが示されています。 非糖尿病動物にAGE-アルブミンを投与すると、AGEsがペリサイトの内側および周囲に局在し、AGE受容体と共局在することで、基底膜の肥厚と血液網膜関門の破壊を引き起こすことが示されています。 さらに、網膜細胞をin vitroでAGEsに曝露すると、血管内皮増殖因子(VEGF)の発現が上昇し、糖尿病性網膜症における網膜新生血管形成に関与する可能性が示唆されています。
糖尿病性ニューロパチー
末梢神経障害と自律神経障害は、神経障害が臨床的に明らかになる前からAGEsレベルと相関することが示されています。 AGE結合コラーゲンレベルを反映する皮膚自家蛍光は、糖尿病性神経障害性足潰瘍の程度と密接な関係があることが報告されています。 AGEsは、糖尿病患者の末梢神経に蓄積し、神経内膜、神経周膜、神経上膜の血管でRAGE受容体と共局在することが示されています。
AGEsと糖尿病のまとめ
以上のように、AGEsの蓄積は、以下のような多彩な病態に関与しています。
- 冠動脈硬化:内皮機能障害、LDL酸化促進、泡沫細胞形成
- 心筋障害:AGEによるコラーゲン架橋が収縮・拡張障害を招く
- 微小血管障害:腎症、網膜症、神経障害における線維化と血流障害
このように、AGEsは「糖毒性」の一側面として、単なるマーカーではなく病因そのものとして機能しているのです。
AGEsの作用機序
AGEsは、以下の3つの主要なメカニズムを介して組織に影響を及ぼします。
- 細胞外マトリックス(基質)タンパク質の架橋: 組織の機械的特性を変化させます。
- 細胞内タンパク質の架橋: 生理機能を変化させます。
- 細胞表面受容体RAGEへの結合: 複数の細胞内シグナル伝達カスケードを誘導します。
組織タンパク質の架橋
- 細胞外マトリックスタンパク質の架橋: AGEsは、コラーゲンやエラスチンなどの細胞外マトリックスタンパク質を架橋し、これらのタンパク質をより硬く、タンパク質分解酵素による分解を受けにくくします。 このAGEsによる架橋は、糖尿病や加齢に伴う血管スティフネスの亢進に関与する可能性があります。 また、心筋コラーゲンのAGEsによる架橋は、糖尿病患者における心筋スティフネスや拡張機能障害の原因となることが示唆されています。
- リポタンパク質の構造変化: AGEsは、低密度リポタンパク質(LDL)を糖化することでその構造を変化させ、内皮細胞による正常なクリアランスを妨げます。 その結果、AGEs修飾LDLは、血液中の単球に取り込まれ、アテローム性動脈硬化の病態形成に関与する泡沫細胞の形成を促進します。
- 細胞内タンパク質の架橋: AGEsは、細胞内タンパク質を架橋し、その生理的特性と機能を変化させることが示されています。 例えば、心筋細胞では、AGEsはリアノジン受容体とSERCA2aの両方のドメインを架橋し、糖尿病性心筋症で報告されているカルシウム恒常性の変化を引き起こします。
心筋コラーゲンとAGEsの架橋形成は、心筋の硬化と糖尿病患者の拡張機能障害を引き起こすと考えられています。
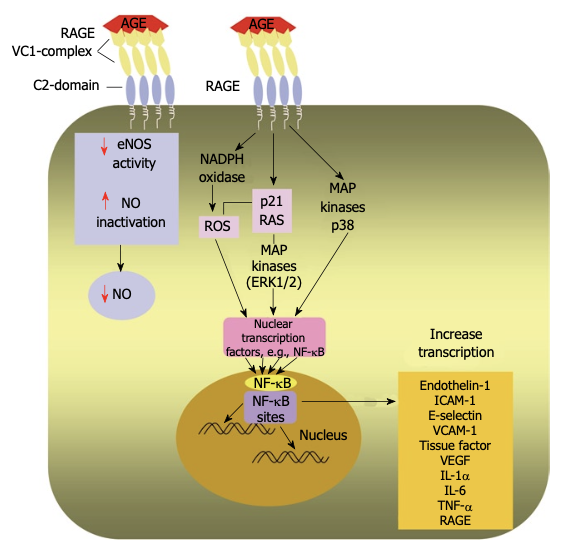
RAGE受容体を介したAGEsの影響
- RAGE受容体の構造と機能: RAGE(Receptor for Advanced Glycation End-products)は、免疫グロブリンスーパーファミリーに属する多重リガンド受容体であり、AGEsが最初に同定されたリガンドです。 RAGEは、細胞外ドメイン、膜貫通ドメイン、細胞質ドメインから構成されています。 細胞外ドメインは、VドメインとC1、C2の2つのCドメインから構成され、VドメインがAGEsと結合します。 RAGEは、AGEsだけでなく、高移動度群タンパク質ボックス-1、S100タンパク質ファミリー、アミロイドβ、フィブリルタンパク質凝集体など、複数のリガンドと結合し、炎症、腫瘍、神経変性、アミロイドーシスなどの病態に関与します。
- RAGEリガンド結合の特異性: RAGEは、多様な化学構造を持つAGEsを認識するパターン認識受容体です。 AGEsは、糖化と酸化の過程で負電荷を獲得し、多量体を形成する傾向があります。 RAGEのVドメインは、正に帯電した領域を持ち、負に帯電したAGEsとの静電的相互作用を介して結合します。
- RAGEの多量体化: RAGEは、細胞膜上で単独で存在するのではなく、複数のRAGE受容体が集合して多量体を形成します。 このRAGE多量体は、AGEsとの高親和性結合と、その後の細胞内シグナル伝達に重要であると考えられています。
- RAGEアイソフォーム: RAGEには、全長RAGE、ドミナントネガティブRAGE(DN-RAGE)、可溶性RAGE(sRAGE)などの複数のスプライスバリアントが存在します。 全長RAGEのみが、リガンドとの相互作用を介して細胞内シグナル伝達を活性化することができます。 DN-RAGEとsRAGEは、AGEsと結合することで、全長RAGEとの競合を介してAGEsのクリアランスと中和を促進します。
- RAGEの組織分布: RAGEは、血管内皮細胞、平滑筋細胞、単球/マクロファージ、Tリンパ球、心筋細胞、糸球体ポドサイト、神経細胞など、様々な細胞に発現しています。 通常、RAGEの発現量は低いですが、糖尿病や加齢などのAGEsが豊富な環境下では、RAGEの発現が亢進します。
AGEs-RAGE結合による心血管系への影響
血清および組織中のAGEsレベルの上昇は、RAGEを活性化し、アテローム性動脈硬化、心血管疾患、腎症、慢性炎症などの重篤な糖尿病合併症の病態形成に関与する複数の細胞内シグナル伝達経路を誘導します。
- 内皮機能障害: 循環血中のAGEsが血管内皮細胞のRAGEに結合すると、NADPHオキシダーゼが活性化され、活性酸素種(ROS)の産生が亢進します。 ROSは、細胞タンパク質、脂質、核酸の構造を変化させ、その生理機能を変化させることで、糖尿病における重篤な心血管障害を引き起こす重要な役割を果たします。
- 炎症とアテローム形成: AGEs-RAGEの相互作用は、p21ras、マイトジェン活性化プロテインキナーゼ(MAPK)、細胞外シグナル調節キナーゼ1/2(ERK1/2)、p38のリン酸化を亢進させ、GTPアーゼCdc42とRac1を活性化します。
これらのシグナル伝達経路は、転写因子NF-κBを活性化し、核内への移行を促進します。
核内に移行したNF-κBは、内皮細胞接着分子(ICAM-1、VCAM-1、E-セレクチン)、血管収縮因子(エンドセリン-1)、組織因子、増殖因子(VEGF)、炎症性サイトカイン(IL-1α、IL-6、TNF-α)などの標的遺伝子の転写を亢進させます。 これらのサイトカインと接着分子は、炎症とアテローム性動脈硬化において中心的な役割を果たします。 - 一酸化窒素(NO)の不活性化: AGEsは、内皮型一酸化窒素合成酵素(eNOS)の活性を低下させ、NOの不活性化を促進することで、NOの利用能を低下させる可能性があります。
AGEsを標的とした治療法
AGEsを標的とした治療法は、AGEsの生成を抑制する方法と、既に形成されたAGEsを分解する方法の2つの主要なカテゴリーに分類できます。
AGEs形成阻害薬
アミノグアニジンは、カルボニル中間体をトラップすることでAGEs形成を阻害するヒドラジン化合物です。1型糖尿病患者を対象としたプラセボ対照無作為化試験では、アミノグアニジンが糸球体濾過率の低下を防ぎ、24時間尿タンパク尿を減少させ、網膜症の悪化を防ぐことが示されました。
ピリドキサミン(ビタミンB6の一種)とベンフォチアミン(チアミンの脂溶性誘導体)もAGEs形成を阻害します。2型糖尿病患者を対象とした研究では、ベンフォチアミンがAGEs豊富な食事による大血管と微小血管の内皮機能障害および酸化ストレスを防ぐことが示されました。
AGEs分解(AGEs架橋切断薬、ALT-711)
ALT-711はチアゾリウム構造を持ち、カルボニル間の炭素-炭素結合を切断することでAGEs架橋を破壊します。in vitroでは、AGEs架橋コラーゲンをALT-711とインキュベートすると、メタロプロテアーゼ(MMP)によるコラーゲン消化性が促進されます。
高齢者(50歳以上)を対象とした第II相臨床試験では、ALT-711(210 mg/日、8週間)が動脈脈圧を減少させ、大動脈のコンプライアンスを改善することが示されました。また、拡張機能不全を有する心不全患者23名を対象としたDIAMOND試験では、ALT-711を16週間投与することで左室重量の減少と左室拡張機能の改善が認められました。
抗RAGE療法
可溶性RAGE(sRAGE)などのRAGE受容体を標的とした治療法は、糖尿病マウスの動脈硬化や糖尿病性網膜症、腎症、神経症などの微小血管合併症を軽減する効果が実験的に示されていますが、臨床応用はまだ承認されていません。
結論と実践的な提言
AGEsは糖尿病の大血管および微小血管合併症の発症に重要な役割を果たしています。心血管疾患、特に心不全におけるAGEsの役割を理解することは、新しい治療戦略の開発につながる可能性があります。
明日から実践できること:
- 血糖コントロールを最適化することでAGEsの生成を減らす
- AGEs豊富な食品(高温調理した肉製品など)の摂取を控える
- 定期的な心血管検査を受け、特に糖尿病患者では心機能評価を考慮する
参考文献
Hegab Z, Gibbons S, Neyses L, Mamas MA. Role of advanced glycation end products in cardiovascular disease. World Journal of Cardiology. 2012;4(4):90–102. doi:10.4330/wjc.v4.i4.90