はじめに:再灌流時代の不整脈をどう捉えるか
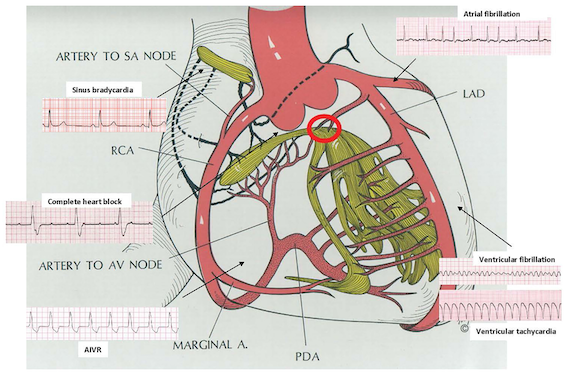
急性心筋梗塞(AMI)後の不整脈は、再灌流療法の普及により大きく減少しました。しかし、発症48時間以内の虚血性不整脈は依然として致死的合併症の一つであり、短期死亡の主要因です。再灌流によって電気的安定性は改善しましたが、虚血・再灌流に伴う細胞死、交感神経緊張、イオンチャネル異常は依然として残存し、心室性・上室性の不整脈を引き起こします。本稿では、Framptonらが提示した急性期不整脈の疫学・病態・治療戦略を、臨床的視点と分子生理学的背景を交えて解説します。
心室性不整脈:再灌流による「電気的ストーム」の抑制と残された課題
Accelerated Idioventricular Rhythm(AIVR)
AIVRはSTEMI症例の約3分の1に出現し、再灌流成功の象徴とされます。Purkinje線維における異常自動能と交感神経刺激が機序であり、多くは自然消失します。治療は不要で、むしろ「再灌流の証」として臨床医が安心すべきサインです。
Premature Ventricular Contractions(PVC)
PVCは電気的不安定性の指標であり、1時間あたり10回以上のPVCを有する患者は死亡率が有意に高いことが示されています(GISSI-2試験)。CAST試験では、PVC抑制目的の抗不整脈薬(フレカイニド等)が逆に死亡率を上昇させる結果となり、薬理的抑制の限界を示しました。現在、PVCに対しては交感神経活動を抑制するβ遮断薬が第一選択です。アミオダロンは高リスク例に限り使用されます。
Non-sustained Ventricular Tachycardia(NSVT)
NSVTは3拍以上30秒未満のVTを指し、発症時期が予後を左右します。MERLIN-TIMI 36試験(n=6,345)では、発症48時間以内のNSVTは突然死と無関係でしたが、遅発性NSVT(4〜7拍:HR 2.3、8拍以上:HR 2.8)は翌年の突然死リスクを有意に上昇させました。急性期のNSVTは自動能亢進やtriggered activityに起因し、一方で遅発性NSVTは瘢痕組織を基盤とするリエントリーが主因です。治療はβ遮断薬が中心で、必要に応じてアミオダロンを併用します。
Ventricular Tachycardia / Fibrillation(VT/VF)
急性期48時間以内にVTまたはVFが発生するのは全AMI患者の約6%であり、APEX-AMI研究では発症群の90日死亡率が23.2%(非発症群3.6%)と著明に高いことが示されました。リスク増加因子として心不全(RR 7.11)、再虚血(RR 4.25)、糖尿病(RR 2.45)、慢性腎疾患(HR 2.53)などが挙げられます。
再灌流やβ遮断薬・ACE阻害薬・スタチン導入後も、心室瘢痕と自律神経異常が持続しうるため、後期VT/VFは依然として問題です。
治療は血行動態の安定度によって異なります。無脈VT/VFではACLSガイドラインに従い、即時除細動と心肺蘇生を行います。アミオダロン静注は再発予防にも有効です。表1では抗不整脈薬がVaughan-Williams分類に基づき整理され、クラスIC薬(フレカイニドなど)はAMI既往例では禁忌とされています。β遮断薬は突然死とVAを減らす唯一の確立治療薬です。
ICDの位置づけ:発作後のタイミングが鍵
ICDの有効性はMADIT・MUSTT・SCD-HeFT試験で確立され、LVEF ≤35〜40%の虚血性心筋症で死亡を有意に減少させます(MADIT HR 0.46、SCD-HeFT HR 0.79)。しかし、発症30〜40日以内の早期植込みは、DINAMIT・IRIS試験で全死亡抑制効果が得られず、早期に機械的死(左室破裂、急性僧帽弁閉鎖不全)が競合するため無効と判明しました。したがって、再灌流後1ヶ月間は経過観察が推奨されます。
上室性不整脈:AFを中心にみる心房性イベント
洞性徐脈・頻脈
洞性徐脈は下壁梗塞の15〜25%に出現し、RCA支配の洞結節虚血や迷走神経反射が原因です。多くは24時間以内に回復し、血行動態低下時のみアトロピンや一時的ペーシングを行います。
一方、洞性頻脈はAMIの40%にみられ、交感神経活性化や心拍出低下に対する代償反応で、前壁梗塞や低LVEFの指標となるため注意が必要です。持続する場合は前壁梗塞・LVEF低下の指標であり予後不良。治療は慎重にβ遮断薬を用います。
心房細動/粗動(AF/AFL)
AMI後のAF発症率は6〜21%であり、急性期は心房虚血、慢性期は左室拡張・圧負荷が関与します。GUSTO-I解析では、AF発症は独立した死亡リスク上昇因子でした(HR約1.7)。さらにHORIZONS-AMI試験では、AF発症群は3年後の大出血(HR 1.74)および主要心イベント(HR 1.73)が有意に増加しました。
CARISMAサブ解析では、LVEF <40%のAMI患者271名のうち39.3%が2年以内にAFを発症し、そのうち16%は最初の2ヶ月以内に出現しました。90%は無症候性であった点は臨床的に重要です。
治療は循環動態に応じて、除細動またはアミオダロン投与、またはレートコントロールを行います。抗凝固療法では、三剤併用(抗血小板+DOAC)を1週〜1ヶ月継続し、その後単剤維持が推奨されます。
高度房室ブロック(AVB)と脚ブロック:解剖学的支配の差が予後を分ける
高位AVBの発症率は再灌流導入後5%未満に減少しましたが、依然として重篤な転帰を取ることがあります。2003–2012年の米国データでは、STEMIに伴う完全房室ブロック例の院内死亡率は20.4%(非発症群8.7%)でした。
RCA支配の下壁梗塞では房室結節虚血や迷走神経亢進により一過性となりやすく、アトロピンで改善します。対照的に、LAD支配の前壁梗塞ではHis束以下の壊死を伴い、不可逆的で恒久ペースメーカーが必要です。NSTEMIでは自然回復率が低く、恒久ペーシング率が高いことも報告されています。
脚ブロック(BBB)
新規BBBは稀だが、完全右脚・左脚ブロックは死亡率増加に関連します。左脚ブロックは右冠+回旋枝の二重血流支配で回復しやすいですが、一方で脚ブロック(特に完全左脚ブロック)は左室同期不全と心不全進展を招きうるため、心臓再同期療法(CRT)が考慮されます。
結論:再灌流時代の課題と臨床実践への示唆
再灌流と薬物療法の進歩により、AMI後の不整脈は劇的に減少しました。しかし、発症後48時間以内のVT/VF、AF、AVBは依然として予後を左右する要因です。
臨床医が意識すべきは、不整脈そのものの抑制ではなく、再灌流・β遮断・電解質是正・早期認識という多面的介入です。とくにβ遮断薬は、電気的リモデリングを抑え、心室性不整脈と突然死を減らす唯一の確実な手段です。
また、AFやAVBを単なる合併症としてではなく、心筋障害のシグナルとして早期に捉える視点が求められます。AMI後の不整脈管理とは「電気の治療」であると同時に、「心筋の回復過程を整える治療」でもあるのです。
参考文献
Frampton J, Ortengren AR, Zeitler EP. Arrhythmias After Acute Myocardial Infarction. Yale Journal of Biology and Medicine. 2023;96(1):83–94.