はじめに
高齢者診療で「とりあえず痛み止め」は、もう通用しません。非ステロイド性抗炎症薬(non-steroidal anti-inflammatory drugs,;NSAIDs)は、疼痛と炎症に非常に有効で、臨床現場の即効性も高い薬剤です。一方で、高齢者では消化管出血・心血管イベント・腎障害など、複数臓器にまたがる有害事象が同時多発しやすく、処方の難易度が一気に上がります。
本総説は、高齢者におけるNSAIDsの薬理(なぜ効いて、なぜ危ないのか)から、主要ガイドラインの立場、臓器別副作用、併用薬との相互作用、さらに「意外な作用(認知機能・筋力・排尿など)」までを一気に整理しています。高齢者医療の現場で、NSAIDsを“使うならどう守るか”という観点を、実務に落とし込める内容です。
なぜNSAIDsは「効く」のか、なぜ高齢者で「危ない」のか
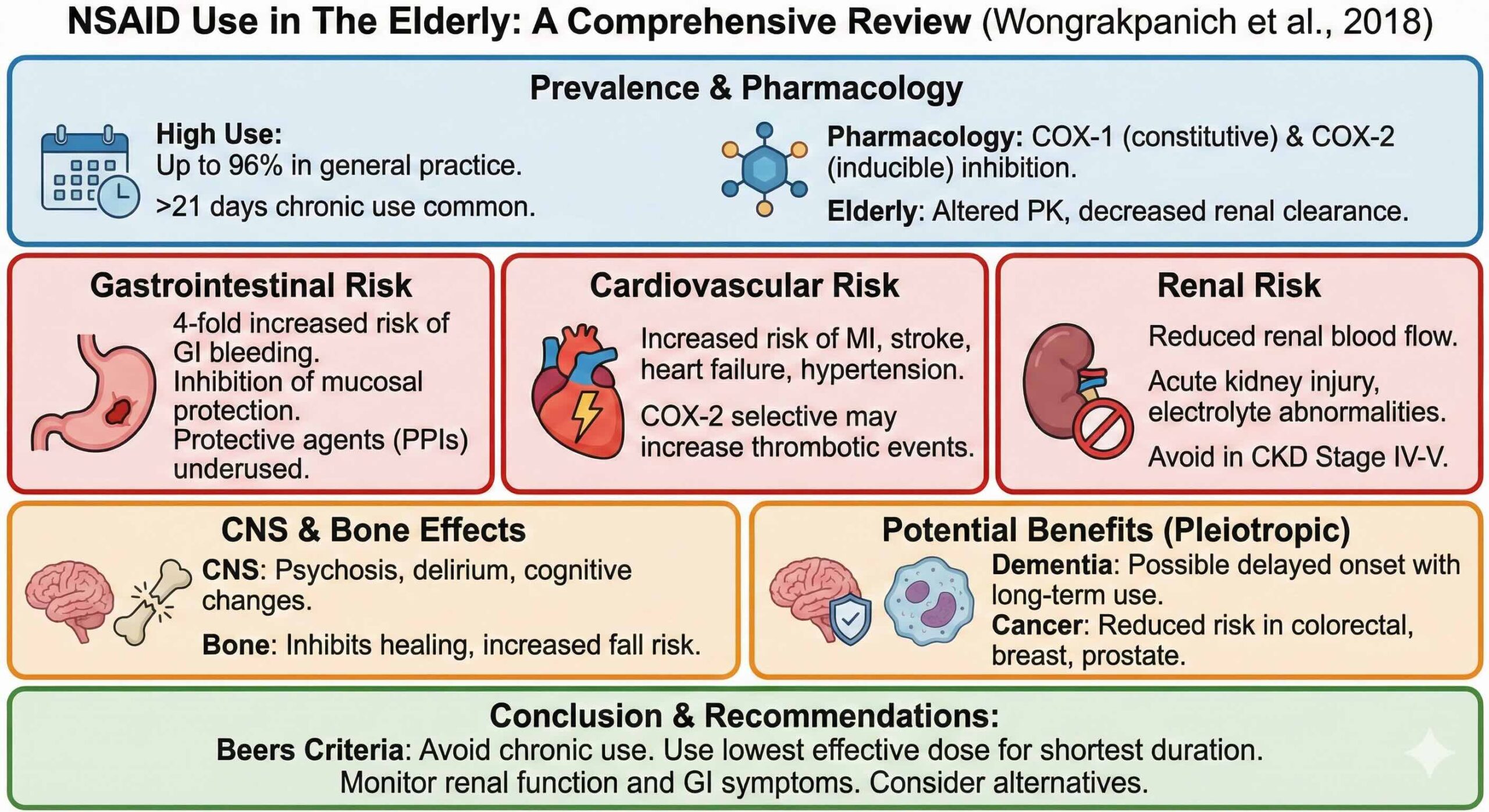
NSAIDsの本質は、プロスタグランジン(prostaglandin;PG)合成の律速酵素であるシクロオキシゲナーゼ(Cyclooxygenase;COX)を阻害することです。ここが臨床効果と副作用の分岐点になります。
- COX-1は、胃粘膜保護、腎血流維持、血小板機能など“日常運転”に関わります
- COX-2は、炎症・痛み・発熱に関わるPG産生が中心です
つまり「鎮痛に必要なのは主にCOX-2抑制」ですが、「胃・腎・止血の破綻はCOX-1抑制で起きやすい」という構造です。COX-2選択的阻害薬(coxib)は消化管毒性が軽減される一方で、心血管・腎毒性が消えるわけではない点が重要です。
さらに高齢者は、体内水分量の低下、蛋白結合率や分布容積の変化など、薬物動態が変動します。半減期も薬剤ごとに極端に違い、例えばアスピリンは0.25〜0.3時間、ピロキシカムは45〜50時間と幅が大きいです。高齢者では、この差が「効きすぎ」や「抜けない副作用」につながります。
高齢者でのNSAIDs使用頻度は“想像以上”に高い
NSAIDsは、年間処方薬の約5〜10%を占める一般的な薬剤群です。総説では、高齢者の使用率が非常に高いことが示されています。一般診療の場では、65歳以上のNSAIDs使用が最大96%に達することがある一方、60歳以上の高齢者で「1年に1回以上NSAIDs処方を受けた割合」が7.3%という報告も紹介されています。集団や定義で差はありますが、少なくとも「かなりの頻度で高齢者に入り込む薬」であることは確実です。
ガイドラインが繰り返す原則:量・期間・副作用モニタ
複数の専門学会(American Geriatric Society、American College of Rheumatology、EULARなど)は、高齢者のNSAIDsを次のように扱うべきだと述べています。
- 最小有効量
- 最短期間
- 消化管・腎・心血管の副作用をルーチンで監視
ここで現実の怖さが出ます。慢性疼痛患者の後ろ向き研究では、NSAIDsを21日以上連続内服していた人が97%という報告があり、「短期間にする」という基本原則が実臨床で守られていない実態が示されています。
さらに2015年改訂のBeers Criteriaでは、NSAIDs(高用量アスピリン含む)の慢性使用は消化管出血リスクのため避けるべきとされ、ハイリスク群として以下が挙げられています。
- 75歳以上
- ステロイド併用
- 抗凝固薬または抗血小板薬併用
臓器別の主要有害事象:高齢者では“連鎖”し得る
消化管:出血リスクは4倍に増加
高齢そのものが消化管出血リスクを上げます。NSAIDsは胃粘膜保護PGを減らし、粘膜バリアを弱めます。総説では、高齢者でNSAIDsにより消化管出血リスクが4倍に増加すると述べられています。
対策として、ミソプロストール(サイトテック錠など)、H2受容体拮抗薬、PPIなどの胃粘膜保護が有効です。ただし、こうした予防策が慢性NSAIDs使用の高齢者で実際に行われているのは約20%という報告が紹介され、現場でのギャップが示されています。
またCOX-2選択的薬(例:celecoxibなど)は非選択的NSAIDsより消化管傷害が少ないとされますが、心血管リスクが別の形で前面に出てくるため、「胃だけ守って終わり」にはできません。
腎:PG抑制で腎血流が低下
NSAIDs腎障害は「まれ」と扱われがちですが、高齢はリスク増大因子です。PG/トロンボキサン合成抑制により腎血管収縮が起き、腎灌流が落ちます。臨床像は多彩で、高カリウム血症、GFR(糸球体濾過量)低下、浮腫、急性間質性腎炎、乳頭壊死、CKD(慢性腎臓病)進行、薬剤性微小変化型ネフローゼなどが列挙されています。
観察研究のメタ解析では、伝統的NSAIDs使用で急性腎障害(acute kidney injury; AKI)リスク上昇が示され、さらに66歳以上1万人超の前向き研究では「累積NSAIDs曝露が高いほどCKDの急速進行リスクが高い」と結論されています。
また入院高齢者のAKI予測モデルでは、NSAIDsと利尿薬の併用などがAKI予測因子として扱われています。
そして最重要のルールとして、AGS(American Geriatric Society)はCrCl 30 mL/min未満(CKD stage IV・V)ではNSAIDsを避けるべきとしています。
心血管:心不全増加・血圧上昇
COX-2阻害薬の一部が心血管イベント増加で市場撤退した歴史(rofecoxib、valdecoxib)以降、NSAIDs全般の循環器リスクが強く意識されるようになりました。
総説では、初回心不全入院をアウトカムにした症例対照研究で、NSAIDs使用が心不全入院リスク増加(OR 2.1、95%CI 1.2–3.3)と報告されています。
血圧については、NSAIDsが平均5 mmHg上げうるとされます。機序として、腎血管系PG抑制による血圧調節障害に加え、このプロセスの中で生じるアルドステロン上昇がNa貯留を来たすと述べられています。
60歳以上の地域住民研究では、NSAIDs使用が高血圧の存在を予測し(OR 1.4、95%CI 1.1–1.7)、高齢者では「降圧薬を飲んでいるのに血圧が上がる」状況を作りやすいことが示唆されます。
加えて、高齢者の約60%がNSAIDsと降圧薬を併用している現状において、NSAIDsはACE阻害薬などの降圧効果を減弱させる「抵抗勢力」として働きます。COX-2阻害薬であっても、この降圧効果の減弱作用からは逃れられません。
高齢者特有の“落とし穴”:転倒と精神症状
転倒:リスク10倍に増加
転倒は、高齢者の予後を一段で悪化させます。総説では、NSAIDs(低用量アスピリン含む)が転倒リスクを10倍に増やすというデータが引用されています。さらにメタ解析では、NSAIDsと転倒の関連がOR 1.21(95%CI 1.01–1.44)とされています。
ここで重要なのは、単なる「ポリファーマシー」ではなく、転倒リスク増加薬(Fall-Risk-Increasing Drugs;FRIDs)を複数使うことが転倒と結びつく、という視点です。NSAIDsはFRIDsの代表格として扱われます。
鎮痛により活動性が上がることで転倒が増えるのか、あるいは中枢神経系への直接作用か、メカニズムの全容は未解明ですが、歩行がおぼつかない高齢者への処方には細心の注意が必要です。
精神症状:稀でも臨床で困る
NSAIDs関連の精神症状(せん妄、幻覚、躁状態など)は頻度こそ高くありませんが、報告例は多く、しかも高齢者が中心です。機序は確定していませんが、中枢でのPG系変化が関与する可能性が述べられています。高齢者で「急に落ち着かない」「妙に不安が強い」などが出たとき、処方歴にNSAIDsがいるかは確認する価値があります。
“意外なベネフィット”が得られる可能性も
この総説の特徴は、NSAIDsを単なる「有害な薬」と断じず、老年医学の視点から多面的に扱っている点です。ここが本論文の新規性の一つです。多臓器毒性を列挙するだけでなく、認知機能、筋力、排尿、がん、脳卒中などへの影響を広くレビューし、「利益の可能性」と「リスクの現実」を同じ俎上に載せています。
- 認知機能:長期NSAIDs使用で認知低下が遅い可能性を示す研究がある一方、7年追跡で関連なし、という研究もあり結論は一貫しません。既存のアルツハイマー病に対しては、celecoxib 200 mgを1日2回、1年間投与しても進行抑制は示されませんでした。
- 筋機能:感染誘発炎症の高齢入院患者で、ピロキシカムが筋パフォーマンスを改善したRCTが紹介されています。
- 排尿:ロキソプロフェンが夜間頻尿の回数や排尿量の改善に関連した研究があり、過活動膀胱の文脈での可能性が示されています。
- がん:COX-2抑制などを介した腫瘍抑制機序が議論される一方、WHI(129,013人、9.7年)では総がんリスクはHR 1.00(95%CI 0.94–1.06)で低下せず、がん種によって差があるとされています。
- 脳卒中:NSAIDsは脳卒中リスクを上げうるとされ、薬剤差も示されます。症例対照研究ではdiclofenacのOR 1.53、aceclofenacのOR 1.67が報告されています。また長期使用が2年時点で脳卒中リスクを64%増加させたという研究も引用されています。
このように「効き目があるかもしれない領域」を提示しつつも、同時に重大リスクが明確に並ぶため、臨床的には“積極的適応”というより「どうしても使うなら守りを固める」という位置づけが現実的です。
明日から実践できる:高齢者NSAIDsの処方設計チェックリスト
1)まず禁忌・高リスクを拾う
- 75歳以上
- 抗凝固薬・抗血小板薬・ステロイド併用
- CKD stage IV/V(CrCl 30 mL/min未満)
このどれかがあるなら、NSAIDsは慎重に再考すべきです。
2)期間と用量の上限を“最初から決める”
原則は、最小有効量・最短期間です。現場では「痛いなら続けていいですよ」が慢性化の入口になります。最初の処方時点で、何日で止めるのか、再診で何を評価して継続可否を決めるのかをセットにします。
3)臓器別モニタリングをルーチン化する
- 消化管:腹部症状、黒色便、貧血兆候
- 腎:eGFR、K、浮腫
- 循環器:体重増加、息切れ、血圧上昇
総説が強調するのは「監視を組み込むこと」です。処方だけで完結させない設計が必要です。
4)併用薬の“危険な組み合わせ”を一度は点検する
総説の相互作用表は高齢者診療の実態そのものです。特に臨床的インパクトが大きいのは以下です。
- 抗凝固薬・抗血小板薬・SSRI・ステロイド:消化管出血リスク増
- ACE阻害薬/ARB、利尿薬、β遮断薬など:降圧効果減弱や腎障害リスク
- ジゴキシン:血中濃度上昇
- メトトレキサート:腎排泄低下による毒性
この確認を「処方前の儀式」にすると、安全性が一段上がります。
Limitation
本論文は、薬理と臨床アウトカムを横断的に整理した有用なレビューですが、限界も明確です。
- 引用されているエビデンスには観察研究が多く、因果関係が確定できない領域があります(例:認知機能、がん、転倒など)。
- NSAIDsの種類・用量・投与期間・併用薬・基礎疾患が多様で、リスクを一つの数値にまとめることは難しいです。
- COX-2選択性や薬剤ごとの違いは示されますが、個々の患者に最適な「薬剤選択アルゴリズム」までを厳密に提示するものではありません。
したがって本総説は、「高齢者にNSAIDsを使うなら、どこに地雷が埋まっているか」を地図化する文献として読むのが適切です。そこから先の個別最適化は、患者背景(腎・心・消化管・転倒リスク、併用薬)を同時に評価して設計する必要があります。
参考文献
Wongrakpanich S, Wongrakpanich A, Melhado K, Rangaswami J. A Comprehensive Review of Non-Steroidal Anti-Inflammatory Drug Use in The Elderly. Aging and Disease. 2018;9(1):143-150. doi:10.14336/AD.2017.0306