はじめに
1980年代にプロトンポンプ阻害薬(PPI)が登場して以来、医療現場と研究者の間には、ある拭いがたい懸念が漂い続けてきました。それは、強力な酸分泌抑制がもたらす代償性の高ガストリン血症が、胃粘膜の悪性変性を引き起こすのではないかという疑念です。ガストリンは胃酸分泌を促すだけでなく、細胞増殖を刺激するホルモンとしての側面も持つため、理論的には発がんのリスクを孕んでいました。事実、これまでに発表された複数のメタ解析では、PPIの使用によって胃がんリスクが約2倍に上昇するという衝撃的な結果が報告されています。しかし、それらの研究は常に「交絡」や「バイアス」という統計学的な霧の中にありました。今回、北欧5カ国のナショナルレジストリを用いた超大規模の、人口ベースの多国籍症例対照研究(Population-based case-control study)が、その霧を晴らし、PPIの真実を白日の下にさらしました。
研究プロトコールの概要(PECO)
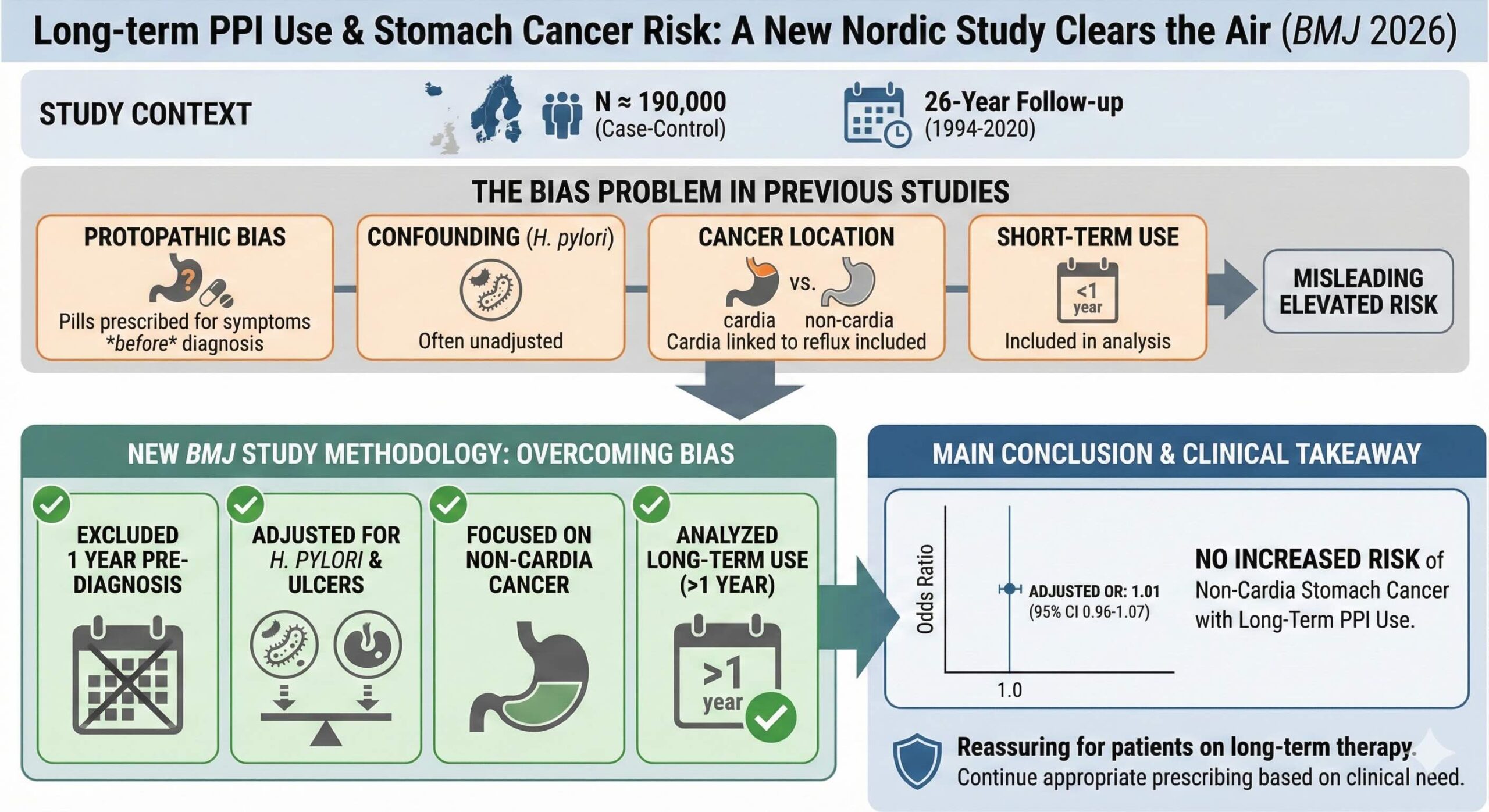
本研究は、デンマーク、フィンランド、アイスランド、ノルウェー、スウェーデンの5カ国において、1994年から2020年までの期間にわたって実施された多施設共同症例対照研究(NordGETS)です。
P(対象者):胃腺がん(非噴門部)と診断された症例患者17232人と、年齢、性別、国をマッチングさせた対照群172297人(計189529人)。
E(曝露):1年を超えるPPIの長期使用(累積処方量から算出)。ただし、診断前12ヶ月間の曝露は除外。
C(比較):PPIの非使用(1ヶ月未満の使用を含む)。
O(アウトカム):非噴門部胃腺がんの発症リスク(オッズ比)。
分子生物学的視点と背景
PPIによる胃がん発生の仮説的メカニズムは、生理学的なフィードバック機構に由来します。PPIが壁細胞のプロトンポンプを阻害してpHが上昇すると、胃のG細胞からガストリンが過剰に分泌される「高ガストリン血症」が誘発されます。このガストリンは、胃底腺の壁細胞や腸クロム親和性細胞様(ECL)細胞に作用し、増殖を刺激します。その結果、胃底腺ポリポージスや粘膜の肥厚が生じ、これらの一部が腺がんに形質転換する可能性が懸念されてきました。動物実験、特にコットンラットを用いた研究では、持続的な高ガストリン血症からECL細胞由来のがんが発生することが確認されています。しかし、人間においてこの経路が実際に臨床的ながん発症に結びつくのかが、長年の争点となっていました。
既存研究を凌駕する圧倒的な新規性
本研究の最大の特徴は、過去の研究を悩ませてきた「4つの主要な限界」を徹底的に排除した設計にあります。
第一に「Protopathic bias プロトパシック・バイアス」の排除です。がんが診断される直前の数ヶ月間は、がん自体の症状(胃不快感など)のためにPPIが処方されることが多く、これが偽の因果関係を生みます。本研究では、診断前12ヶ月間の処方データをあえて切り捨てることで、このバイアスを回避しました。
第二に「交絡の厳密な制御」です。胃がんの最大のリスク因子であるヘリコバクター・ピロリ(H. pylori)に関連する変数を調整しました。具体的には、除菌治療歴や胃潰瘍・十二指腸潰瘍の既往をモデルに組み込んでいます。
第三に「がんの局在の厳格な分類」です。胃酸逆流が直接的な原因となる「噴門部がん」を解析から除外しました。PPIの使用理由そのものがリスク因子である噴門部がんを含めると、結果が不当に高く出てしまうためです。
第四に「長期曝露の定義」です。1年未満の短期使用をあえて解析の主眼から外し、蓄積されたダメージを評価できる1年以上の継続使用者のみに焦点を当てました。
結果
PPIの長期使用と非噴門部胃腺がんのリスクに関連なし
全17232人の症例と172297人の対照群を対象とした多変量解析の結果、PPIの長期使用と非噴門部胃腺がんのリスクとの間には、全く関連が認められませんでした。調整後のオッズ比は1.01(95%信頼区間 0.96-1.07)であり、統計学的にも完璧な「有意差なし」を示しています。
ヒスタミンH2受容体拮抗薬(H2RA)もリスク増加なし
この結果の堅牢性を裏付けるため、研究チームはヒスタミンH2受容体拮抗薬(H2RA)の長期使用者についても同様の解析を行いました。H2RAはPPIほど強力な高ガストリン血症を引き起こさない薬剤ですが、こちらでも調整後オッズ比は1.03(95%信頼区間 0.86-1.23)と、リスクの増加は見られませんでした。
過去の研究のバイアス
さらに興味深いのは、バイアスがどのように結果を歪めるかを検証した追加解析です。もし、診断前の除外期間を12ヶ月ではなく6ヶ月に短縮した場合、オッズ比は1.11に上昇しました。また、1年未満の短期使用を含めた「PPI使用経験あり」という広いカテゴリーで解析すると、オッズ比は1.18(95%信頼区間 1.13-1.23)となり、あたかもPPIがリスクであるかのような「偽陽性」の結果が再現されました。これは、過去の研究がいかにバイアスの影響を強く受けていたかを如実に物語っています。
研究の限界(Limitation)
完璧に見える本研究にも、いくつかの限界は存在します。
まず、ナショナルレジストリを用いた症例対照研究であるため、食事因子(特に塩分摂取量)や詳細な喫煙歴、家族歴といった個別の詳細なライフスタイルデータが欠落している可能性があります。ただし、著者は、塩分摂取が西洋諸国において極端に強いリスク因子ではないことや、家族歴やゾリンジャー・エリソン症候群のような稀な疾患が結果を左右するほどの影響力は持たないと考察しています。
また、北欧という特定の地域での研究であるため、人種や環境因子が大きく異なる他地域への一般化には慎重であるべきですが、生物学的なメカニズムの普遍性を考えれば、その信頼性は極めて高いと言えます。
明日からの臨床と行動への示唆
この論文は、PPIを必要とする何百万人もの患者と、それを処方する臨床医にとって、強力な「免罪符」となります。私たちが明日から実践すべき行動は以下の通りです。
- 患者の不安を科学的に解消する「PPIを長く飲むと胃がんになる」という古い情報やインターネット上の噂に怯えている患者に対し、北欧19万人のデータでリスク増加(1.01という数値)が否定されたことを明確に説明してください。
- 適切な適応に基づいた処方の継続胃食道逆流症(GERD)やバレット食道、難治性潰瘍の維持療法において、PPIのメリットが潜在的ながんリスクを遥かに上回ることが確認されました。恐怖心からくる不適切な休薬を防ぐことが重要です。
- 診断前のPPI処方には慎重な洞察を解析結果から、診断直前のPPI使用がリスクを高く見せていたことが分かりました。これは、胃の不調を訴える患者に安易にPPIを処方して経過を見ることで、背後にある胃がんの発見が遅れる(マスクされる)リスクを示唆しています。安易な対症療法としてのPPI処方の前に、内視鏡検査による器質的疾患の除外を徹底すべきです。
- PPIの真の副作用に目を向ける胃がんリスクが否定された一方で、論文内でも触れられているように、クロストリジウム・ディフィシル関連下痢症、骨粗鬆症、ビタミンや電解質の吸収不全といった他の既知の副作用については、依然として注意が必要です。漫然とした処方を避け、定期的に継続の必要性を評価するという基本に立ち返りましょう。
結論として、PPIは適切に使用される限り、胃がんという大病を恐れることなく利用できる極めて有用なツールであることが再確認されました。30年にわたる疑惑に終止符を打ったこの知見は、医療における「正確な統計学的補正」がいかに重要であるかを教えてくれます。
参考文献
Duru O, Santoni G, Holmberg D, Birgisson H, Kauppila JH, von Euler-Chelpin M, Ness-Jensen E, Lagergren J. Long term use of proton pump inhibitors and risk of stomach cancer: population based case-control study in five Nordic countries. BMJ. 2026;392:e086384. doi: 10.1136/bmj-2025-086384.
補足:研究デザインのやさしい説明
この研究は、膨大なデータを使いながらも、非常にシンプルかつ緻密な手順で進められています。誰でもイメージが湧くように、5つのステップに分けて解説します。
ステップ1:解析対象の特定(誰を調べたか)
まず研究チームは、北欧5カ国の公式な「がんレジストリ」から、1994年から2020年の間に胃がん(非噴門部腺がん)と診断されたすべての患者さんを探し出しました 。その数は17,232人です 。この人たちを「症例グループ」と呼びます。
ステップ2:比較グループの選出(公平なライバル選び)
次に、がんではない健康な人と比較するために、北欧の全人口から、がん患者1人に対して10人ずつ、合計172,297人をランダムに選び出しました 。この人たちを「対照グループ」と呼びます 。 単にランダムに選ぶのではなく、年齢、性別、住んでいる国、同じ時期に登録されていること、などの条件をがん患者さんとぴったり揃えています 。これにより、年齢や性別の差による不公平をなくしました。
ステップ3:処方記録の追跡(全員の「お薬手帳」をチェック)
ここで、特定された189,529人全員について、国が管理する「処方薬レジストリ」を調べました 。このレジストリには、いつ、誰が、どの薬を何日分受け取ったかという正確な記録が残っています 。 医師が処方箋を書いただけでなく、実際に薬局で薬を受け取った記録のみをカウントすることで、情報の正確性を高めています 。
ステップ4:時間の区切り方(5年と1年のルール)
ここが最も重要な工夫です。研究チームは、がんの診断日(または比較日)から遡って過去5年間の記録を見ました 。しかし、診断直前の12ヶ月間(1年間)については、薬の記録があっても「あえて無視」して計算から除外しました 。 理由は、がんが見つかる直前の胃の不快感のためにPPIが処方されることが多いため、それをカウントすると「薬のせいでがんになった」という勘違い(バイアス)が生まれてしまうからです 。つまり、実質的には診断の「5年前から1年前まで」の4年間の服薬履歴を評価しています 。
ステップ5:最終的な比較と調整(リスクの計算)
最後に、PPIを1年以上(累積)飲んでいた人が、がん患者グループにどれくらいいたか、比較グループにどれくらいいたかを比べました 。 さらに、胃がんの真の原因になりやすいピロリ菌の治療歴、タバコに関連する病気、アルコールに関連する病気、肥満、糖尿病などの影響を統計的に取り除きました 。 これらの邪魔な要因をすべて整理した結果、PPIを飲んでいる人と飲んでいない人の間で、胃がんの発症リスクに差はなかった(1.01倍)という結論に達しました 。