はじめに
動脈硬化性心血管疾患(Atherosclerotic Cardiovascular Disease;ASCVD)は、依然として世界的な主要死因となっています。近年、古典的リスク因子に加え、Lipoprotein(a)(Lp(a))が独立したASCVDリスク因子として注目を集めています。本解説では、2025年4月にJAMAに掲載されたMoraとKronenbergによる最新のレビューを基に、Lp(a)の生物学的特性から臨床的意義、管理戦略までを包括的に解説します。
こちらも参考に。
Lipoprotein(a)とは何か
Lipoprotein(a)は、低密度リポタンパク質(LDL)様粒子にアポリポタンパク(a) [apo(a)] が共有結合した構造を持ちます。特に注目すべきは、Lp(a)が酸化リン脂質を運搬し、強い炎症促進性と動脈硬化促進性を有する点です。この独自の構造により、単なるLDLコレステロールとは異なる心血管リスクをもたらします。
Lp(a)とASCVDリスク:疫学的証拠
複数の前向きコホート研究およびメタ解析により、Lp(a)高値とASCVD発症リスクの間に強固な関連が示されています。
たとえば、29,069例を対象としたメタ解析では、Lp(a) ≥50 mg/dL群におけるASCVD発症率は80.0/1000人年(95% CI, 75.3-84.9)であり、<15 mg/dL群(55.3/1000人年、95% CI, 53.4-57.3)と比較して調整ハザード比1.35(95% CI, 1.11-1.66)の有意なリスク増加が認められました。
また、UK Biobank(460,506名)でも同様の結果が確認され、20 mg/dL増加ごとにASCVDリスクが1.11倍(95% CI, 1.10-1.12)上昇することが報告されています。これらのデータは、Lp(a)とASCVDリスクの間に連続的かつリニアな関係が存在することを裏付けています。
この関連は、LDLコレステロールを含む従来の心血管危険因子やさまざまなリスクスコアによっても有意に影響を受けません。
Lp(a)高値によるリスク上乗せ効果の可視化
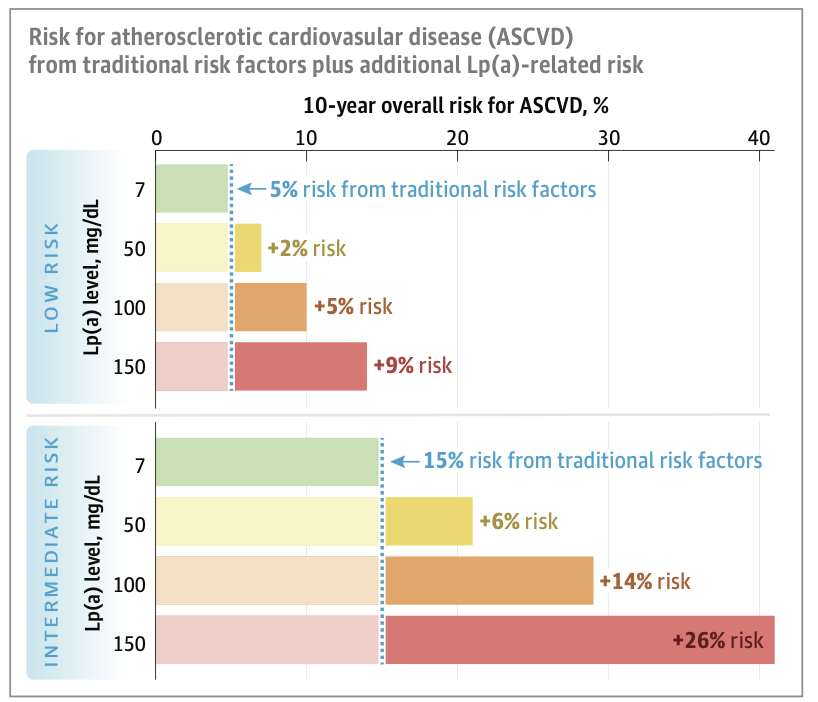
さらに本論文では、伝統的リスク因子に基づくASCVDリスクに、Lp(a)高値がどのように追加的リスクをもたらすかを可視化した図が提示されています。
UK Biobankに基づくデータを用いて、10年ASCVDリスク5%の「低リスク群(LOW RISK)」と15%の「中間リスク群(INTERMEDIATE RISK)」を設定し、それぞれにLp(a)濃度別のリスク上昇幅を重ねて示しています。
たとえば、低リスク群でLp(a)濃度が50 mg/dLの場合、追加リスクは+2%に留まるものの、100 mg/dLで+5%、150 mg/dLでは+9%に達し、絶対リスクが5%から14%へと急上昇します。
同様に中間リスク群では、Lp(a)150 mg/dLの場合、追加リスクは+26%に達し、リスクは15%から40%以上にまで跳ね上がります。
これらのデータは、Lp(a)高値がもたらすリスク増加が連続的かつ量依存的であり、基礎リスクの高い患者ほど影響が著しいことを直感的に示しています。元来の心血管リスクが高い患者ほど、Lp(a)高値による相乗的ダメージが大きいのです。この可視化により、Lp(a)測定の臨床的意義、ならびに高値患者に対するリスク低減戦略の必要性が一層明確になっています。
補足:リスク分類における日米の違い
なお、ASCVDリスクの分類基準には国による違いが存在することにも留意が必要です。
米国のACC/AHAガイドラインでは、10年ASCVDリスクが5%未満を「低リスク」と定義しており、今回の図における「LOW RISK」層(5%)はこの分類に準じています。
しかし、日本動脈硬化学会(JAS)が提唱するガイドラインでは、10年リスク2%未満を「低リスク」、2%以上9%未満を「中リスク」と定義しており、日本人集団におけるリスク基準はより厳格です。この背景には、日本人が欧米人に比べ冠動脈疾患発症率が低い一方で、脳卒中リスクが比較的高いという疫学的特性が反映されています。
したがって、臨床応用に際しては、米国基準のリスク層分類をそのまま日本人に適用するのではなく、日本人特有のリスクプロファイルを考慮したうえで、Lp(a)高値によるリスク上乗せ効果を慎重に評価する必要があります。
分子生物学的視点からみたLp(a)
Lp(a)の血中濃度は、ほぼLPA遺伝子によって規定されます。ライフスタイル要因(禁煙、運動、食事)の影響はほとんどなく、生涯にわたり比較的一定です。さらに、人種差も大きく、白人集団における中央値(四分位範囲)は7(3-29)mg/dLであるのに対し、黒人集団では約30(18-54)mg/dLと約4倍高値であることが示されています。2020年の英国バイオバンク研究では、中国人は白人に比べて約15%低く、南アジア人は約60%高いLp(a)値を示しました(中央値:中国人16 nmol/L、黒人75 nmol/L、南アジア人31 nmol/L、白人19 nmol/L)。
この背景には、LPA遺伝子座の遺伝的多型が関与していると考えられています。
重要な点は、メンデル無作為化研究においても、LPA遺伝子変異による生涯高Lp(a)曝露がASCVDリスクを有意に高めることが確認されていることです。このことは、単なる相関ではなく、因果関係が存在することを強く示唆しています。
(ちなみに、Lp(a)の分子量はアポ(a)のサイズ(クリングルリピート数)で異なるため、nmol/Lとmg/dLの単位の単純換算には不確実性が存在します。注意が必要です。)
ガイドラインにおける位置づけ
2018年のAHA/ACCコレステロールガイドラインと2019年の予防ガイドラインでは、スタチン開始や用量増量に関する意思決定において、Lp(a)高値が臨床的に有用である可能性が示されています。
欧州ガイドライン(クラスIIa、エビデンスレベルC)とカナダガイドライン(強く推奨、高品質エビデンス)は、すべての成人に対して生涯に一度はLp(a)を測定することを推奨しています。このアプローチは、アメリカ心臓協会(2022年)とNational Lipid Association(2024年、クラスI、エビデンスレベルB-NR)の最近の科学的声明でも支持されています。
ただし、現時点では、Lp(a)測定が転帰を改善することを示した無作為化試験は存在せず、薬物療法によるLp(a)低下が心血管転帰を改善することを示した臨床試験も完了していません。
管理戦略:現時点でできること
Lp(a)値が50 mg/dL以上の患者に対しては、心血管イベントの危険因子を修正するようアドバイスする必要があります。Lp(a)自体を直接標的とする治療は現状限定的であり、リスク因子の最適管理が推奨されます。すなわち、
- 禁煙
- 地中海食を基盤とした食事
- 規則的な運動
- LDLコレステロール、血圧、血糖の厳格管理
が基本方針となります。
生活習慣介入
喫煙中止、減量、健康的な食事(地中海食など)、身体活動などが含まれます。ただし、これらの介入が直接Lp(a)値を低下させるわけではない点に注意が必要です。Lp(a)値自体は生活習慣の影響をほとんど受けませんが、他の心血管危険因子を管理することで全体的なリスクを減らすことが可能です。
薬物療法
スタチン
スタチンはLp(a)を低下させず、一部の個人ではわずかに上昇させる可能性があります。しかし、スタチンがASCVDイベントを有意に減少させるという強力なエビデンスがあるため、Lp(a)のわずかな上昇を理由に中止すべきではありません。
PCSK9阻害剤
PCSK9阻害剤はLDLコレステロールを50-60%、Lp(a)を15-30%低下させます。しかし、高Lp(a)患者を対象に選択的にPCSK9阻害剤を評価した無作為化臨床試験はなく、現在のところこれらの薬剤はLp(a)低下を目的として承認されていません。
リポタンパクアフェレシス
リポ蛋白アフェレーシスとは、人工透析のように血液を体外循環させ、特殊な吸着カラムでLDLやLp(a)を選択的に除去する治療法です。
週1回のリポ蛋白アフェレーシスはLp(a)を約30-35%低下させ、家族性高コレステロール血症かつ冠動脈または末梢動脈疾患があり、Lp(a)が60 mg/dL(または130 nmol/L)以上の患者に対して米国食品医薬品局(FDA)に承認されています。レジストリデータは、アフェレーシス治療を受けたLp(a)値60 mg/dL超の患者においてASCVDイベントの有意な減少を示していますが、これらの研究にはシャムアフェレーシス対照群が含まれていなかった点に留意が必要です。コントロール群を伴うRCTデータは存在しません。
低用量アスピリン
出血リスクが高くない個人においては、高Lp(a)に対して低用量アスピリンを考慮することができます。2つの一次予防無作為化プラセボ対照試験の事後解析では、アスピリンが遺伝的に高Lp(a)の患者においてASCVDイベントリスクを低下させることがわかり、いくつかの観察研究と一致しています。ただし、高Lp(a)レベルで選択された患者を対象にアスピリンを研究した無作為化臨床試験は存在しません。
新たな治療選択肢:RNA干渉技術と小分子阻害薬
最近の進歩により、皮下投与されるpelacarsen、oipasiran、lepodisiran、zerlasiranなどのmRNA療法や、肝臓でのLp(a)形成を阻害する経口小分子阻害剤muvalaplinなど、特異的なLp(a)低下が可能になりました。これらの薬剤はapo(a)の産生を阻害することで、用量依存的にLp(a)を最大99%まで減少させます。現在、これらのLp(a)低下薬がASCVDイベント率を減少させるかどうかを評価する無作為化臨床試験が進行中です。
- mRNA分解薬(pelacarsen, olpasiran, lepodisiran, zerlasiran)
- 小分子阻害薬(muvalaplin)
臨床的実践への応用
臨床現場では、以下のような実践的な対応が推奨されます。
- リスク評価:特に早発性ASCVDの家族歴がある患者や、他の危険因子に対して不釣り合いなASCVDを有する患者において、Lp(a)測定を考慮します。測定は生涯に一度で十分です。
- 総合的リスク管理:Lp(a)高値が確認された場合、LDLコレステロール、血圧、血糖などの他の危険因子をより積極的に管理します。地中海食の採用、定期的な運動、喫煙中止などの生活習慣改善を強く推奨します。
- 患者教育:Lp(a)が遺伝的に決定される性質や、現在進行中の治療開発について説明し、過度の不安を軽減しながらも適切な警戒を促します。
- 研究参加の機会:適切な患者には、新規Lp(a)低下療法の臨床試験への参加を検討するよう提案します。
結論
50 mg/dL以上の高リポ蛋白(a)値は、ASCVDイベント率の増加と関連しています。Lp(a)値が高い患者に対しては、喫煙中止、身体活動、地中海食などの生活習慣管理、コレステロール低下療法、血圧管理などの包括的なアプローチが必要です。しかし、Lp(a)自体が修正可能な危険因子であり、低下させるべきかどうかについては、現在進行中の臨床試験の結果を待つ必要があります。
今後の研究によって、Lp(a)を特異的に標的とする治療法の有効性が明らかになれば、心血管疾患予防のパラダイムが大きく変化する可能性があります。臨床医は、この分野の進展に注意を払いながら、現時点で利用可能な最善のエビデンスに基づいて患者ケアを行うことが求められます。
参考文献
Mora S, Kronenberg F. Lipoprotein(a). JAMA. Published online April 24, 2025. doi:10.1001/jama.2025.2373