はじめに
慢性腎臓病(CKD)は、単なる腎機能の低下にとどまらず、心血管疾患(CVD)発症の重要な温床として広く認識されています。特に、脂質異常症の特徴とその管理がCKD患者の予後を大きく左右することが、近年の研究により明らかになってきました。本稿では、CKDにおける脂質代謝異常の特性、スタチンや非スタチン治療薬の有効性、そして治療介入の現状と限界について解説します。
CKDの脂質異常の特徴:TG上昇とHDL-C低下が中心
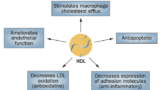
CKDでは、従来の高LDL-C型とは異なる脂質異常がみられます。典型的にはトリグリセリド(TG)の上昇とHDLコレステロール(HDL-C)の低下が中心であり、LDL-Cは著明には上昇しません。腎機能の悪化により、リポ蛋白リパーゼ(LPL)やLDL受容体の発現が低下し、TGリッチリポ蛋白の分解遅延が起こることでTG値が上昇します。また、HDL-Cは量的低下に加え、抗酸化・抗炎症機能が劣化しており、質的変化も問題となっています。
さらに、レシチン-コレステロールアシルトランスフェラーゼ(LCAT)活性の低下やコレステリルエステル転送タンパク(CETP)の活性上昇がHDL-C低下に寄与しているとされます。2001〜2010年のNHANESデータでは、CKDステージ1で脂質異常の有病率が45.5%、ステージ4では67.8%にまで増加しており、CKD進行に伴い脂質異常も悪化することが示されています。
こちらも参考に。
リポ蛋白粒子の構造と機能の変化:単なる数値以上の意義
CKDではリポ蛋白の構造的な変化も重要です。特に、小型・高密度LDL(small dense LDL)の増加は動脈硬化促進因子として注目されています。ある研究では、CKDステージ4/5患者のLDL粒子には、ホスファチジルコリンやセラミドの低下、N-アシルタウリンの増加といった組成変化が認められ、これがアテローム形成に関与している可能性が示唆されています。
リポ蛋白は単なる脂質輸送体ではなく、マイクロRNAやサイトカインを含む「情報伝達粒子」としての役割も担っており、この“cargo”の変化がCKD特有の動脈硬化進展に関与していると考えられます。
補足:細胞外小胞(exosome)との共通性
cargoという概念は、細胞外小胞(exosomesやmicrovesicles)においても用いられており、これらもマイクロRNA・タンパク質・脂質などを特定のターゲット細胞に運ぶ役割があります。リポ蛋白はそれと機能的に類似した「情報運搬体」ともいえます。
スタチン治療の位置付け:透析前と後で効果は異なる
スタチン療法は、CKDステージ1〜4や腎移植後患者においては有効性が確認されています。たとえば、Heart Protection Studyでは腎機能低下群においてシンバスタチン投与により主要CVDイベントが28%減少しました。さらに、Pravastatin Pooling ProjectではCKDステージ3患者におけるCVDイベントが23%減少し、有意な介入効果が示されました。
しかし、透析患者を対象とした4D試験やAURORA試験では、LDL-Cの低下はあってもCVDイベントの抑制にはつながらなかったという結果が得られています。この理由として、透析患者では炎症・酸化ストレスや尿毒素など非脂質性要因による動脈硬化の寄与が大きく、脂質介入の限界があると考えられています。
スタチン以外の選択肢:多様化する治療戦略
非スタチン薬としては、以下のような選択肢が挙げられます。
- エゼチミブ:腸管コレステロール吸収を阻害し、LDL-Cを15〜20%低下。SHARP試験では、シンバスタチン+エゼチミブ群においてCVDイベントを有意に減少。腎機能への悪影響はなく、透析非実施CKD患者に有用です。
- フィブラート系薬剤:TG↓・HDL-C↑が主作用。腎排泄であるため使用には注意が必要ですが、いくつかの試験ではアルブミン尿の進行抑制やCVDリスク低下も報告されています。
- ナイアシン(ニコチン酸):HDL-C↑・TG↓に加え、リン低下作用もあり、CKDにおいて注目されています。小規模試験ではGFR改善効果も報告されていますが、副作用(皮膚紅潮)や大規模試験の欠如が課題です。
- PCSK9阻害薬(アリロクマブ等):LDL-Cを強力に低下させ、eGFR低下例でも安全性が高いとされます。ただし、透析患者での有効性は限定的であり、より多くのデータが必要です。
- ベンペド酸・インクリシラン:新規薬剤であり、CKDステージ3未満では使用可能ですが、ESRDでのデータはまだ不十分です。今後のアウトカム試験に期待がかかります。
CKD患者における実践的な治療戦略
CKDにおける脂質異常症の管理は、患者のステージに応じて柔軟に対応する必要があります。
- CKDステージ1〜4の成人には、原則としてスタチン(またはスタチン+エゼチミブ)の投与を推奨します。
- 透析中の患者では、特にLDL-Cが非常に高値(例:>145mg/dL)の場合を除き、スタチンの投与は原則不要とされます。
- 腎移植後の患者では、スタチンにより心筋梗塞や突然死のリスクが低下することが報告されており、第一選択薬として考慮されます。
重要なのは、腎機能に応じた用量調整を行い、副作用のリスクを最小限にすることです。たとえば、ロスバスタチンはeGFR<30の症例では最大投与量が10mg/dayに制限されます。
おわりに:多因子的な視点からのアプローチが求められる
CKDにおける脂質異常は、単なる数値的異常ではなく、粒子の質的変化や腎・心連関病態と深く関連しています。スタチンがすべてのCKD患者に有効とは限らない中、病態に即した薬剤選択と、炎症・酸化ストレスのような非脂質性要因への介入が今後ますます重要になります。
臨床の現場では、患者の病期、合併症、生活背景を総合的に考慮し、「誰に、いつ、どの薬剤を、どの用量で使用すべきか」という視点での対応が求められます。明日からの診療において、eGFRだけでなくHDLの質、TGの動態、リポ蛋白の構成にも着目することが、CKD患者のCVDリスク管理において一歩先を行く医療につながると考えます。
参考文献
Lacount S, Tannock LR. Dyslipidemia in Chronic Kidney Disease. In: Feingold KR, Anawalt B, Boyce A, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000–. Updated April 30, 2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK305899/