はじめに
過活動膀胱(Overactive bladder;OAB)は、高齢化社会において極めて一般的な疾患であり、その治療薬は多くの患者の生活の質を支えています。しかし、これらの薬剤が心臓の微細なリズムを乱す可能性については、これまで断片的な報告に留まっていました。最新の国際的な大規模データ解析は、私たちが日常的に処方、あるいは使用している薬剤が、時に重大な心血管イベントである心房細動(atrial fibrillation;AF)の引き金となり得ることを示唆しています。本稿では、日本とアメリカの巨大な自発報告データベースを統合・比較し、薬剤と心房細動の間に潜む「負の相関」を浮き彫りにした最新の研究成果を詳細に解説します。
研究プロトコールの概要(PECO)
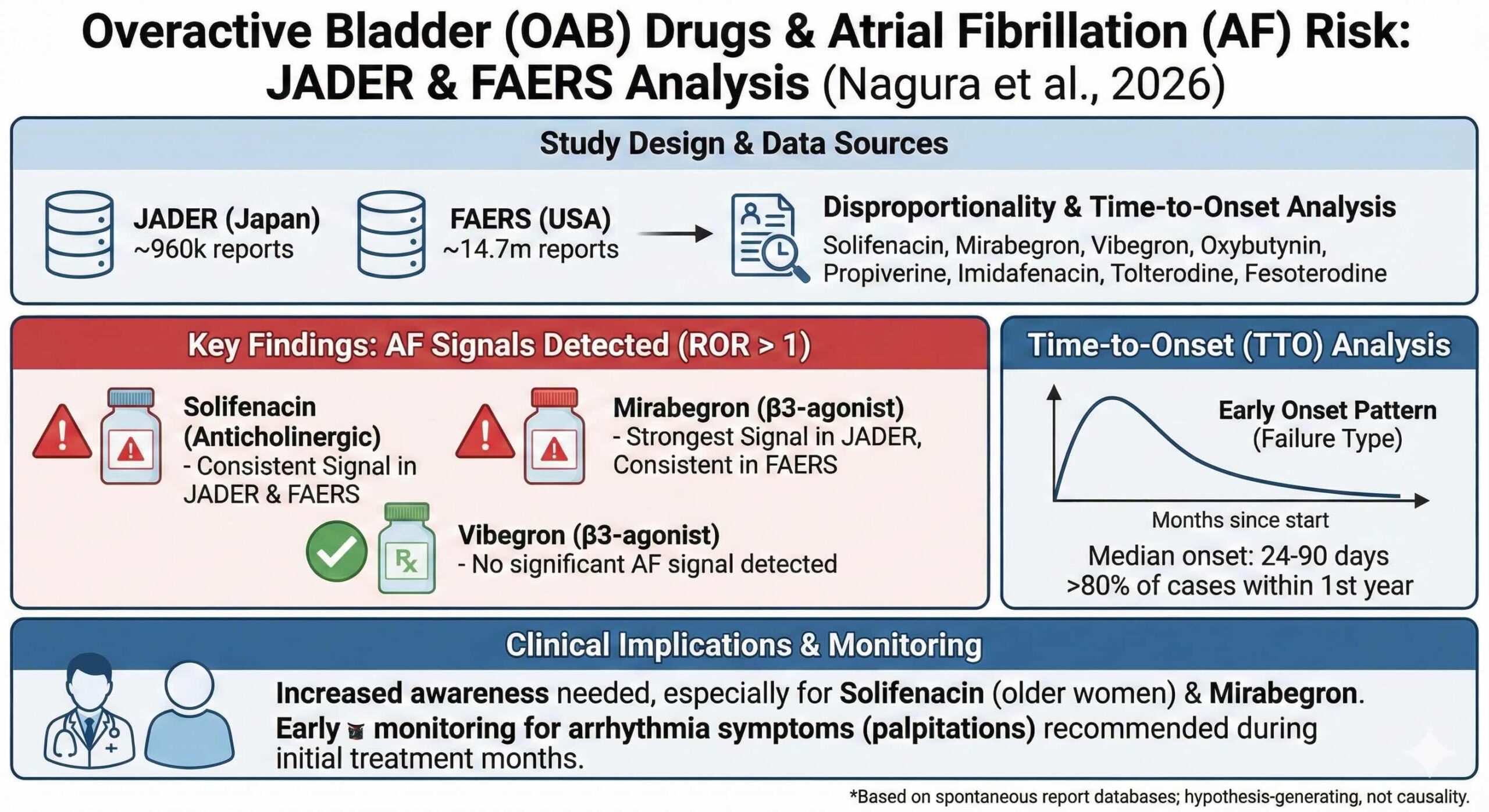
P(対象):日本(JADER:約96万件)および米国(FAERS:約1469万件)の有害事象自発報告データベースに登録された全症例
E(曝露):8種類の過活動膀胱治療薬
・オキシブチニン:ポラキス錠/ネオキシテープ (抗コリン薬)
・プロピベリン:バップフォー錠(細粒) (抗コリン薬)
・ソリフェナシン:ベシケア錠 (抗コリン薬)
・イミダフェナシン:ウリトス錠/ステーブラ錠 (抗コリン薬)
・トルテロジン:デトルシトールカプセル (抗コリン薬)
・フェソテロジン:トビエース錠 (抗コリン薬)
・ミラベグロン:ベタニス錠 (β3作動薬)
・ビベグロン:ベオーバ錠 (β3作動薬)
C(比較):上記薬剤以外の全ての報告薬剤
O(アウトカム):心房細動
既存研究に対するこの研究の新規性
本研究の最大の新規性は、単一の国や単一の薬剤に限定せず、日本(JADER)と米国(FAERS)という医療背景や民族構成の異なる二大データベースを同時に用いて、8種類の過活動膀胱治療薬を網羅的に直接比較した点にあります。従来の臨床試験は観察期間が短く、心房細動のような発生頻度が比較的低く、かつ「静かな」事象を見逃す傾向がありました。本研究は、実臨床のビッグデータを用いることで、薬剤ごとのリスクシグナルの差異を明確にし、さらに発現時間(time-to-onset;TTO)や患者背景による層別化解析を行うことで、より精緻なリスクプロファイルを構築することに成功しました。
主要解析結果:浮かび上がった二つの薬剤
膨大なデータを解析した結果、日米両国のデータベースで一貫して強力なリスクシグナルを示した薬剤が二つ特定されました。抗コリン薬であるソリフェナシン(代表的商品名:ベシケア)と、β3アドレナリン受容体作動薬であるミラベグロン(代表的商品名:ベタニス)です。
具体的には、ソリフェナシンの報告オッズ比(reporting odds ratio;ROR)※は、JADERで2.19(95%信頼区間 1.35から3.53)、FAERSで1.80(95%信頼区間 1.54から2.10)でした。
一方、ミラベグロンはさらに顕著で、JADERでのRORは4.00(95%信頼区間 2.88から5.57)、FAERSでは1.98(95%信頼区間 1.77から2.22)という数値を示しました。これらの数値は、他の過活動膀胱治療薬と比較しても際立っています。例えば、最新のβ3作動薬であるビベグロン(商品名:ベオーバ)については、JADER、FAERSともに統計的な有意差を伴うシグナルは検出されませんでした。
※Reporting Odds Ratio (ROR) とは、医薬品の副作用自発報告データベース(JADERやFAERSなど)を用いた「不均衡分析」において、特定の薬剤と副作用の関連性を評価するための統計指標です 。
簡単に言えば、「その薬において、特定の副作用が他の薬よりもどれくらい多く報告されているか」を比率で表したものです 。
RORはあくまで「報告の偏り」を示すものであり、その薬が副作用を直接引き起こしたという「因果関係」や「リスクの大きさ」を確定するものではありません。
層別化解析:誰が特に注意すべきか
研究チームはさらに、性別、年齢、併用薬数による層別化解析を行い、リスクが顕在化しやすい集団を特定しました。
ソリフェナシンについては、JADERにおいて女性、70歳から99歳の高齢層、および併用薬が5剤未満の比較的健康な集団で有意なシグナルが認められました。日本国内におけるソリフェナシンの処方の約60%が女性であり、かつ高齢者の割合が85%に達するという利用実態が、この結果に反映されている可能性があります。
ミラベグロンは、より広範な集団でシグナルが確認されました。FAERSでは性別、年齢層を問わず一貫してシグナルが認められ、特に併用薬が少ない集団(5剤未満)でのRORは2.41(95%信頼区間 2.02から2.86)と高い値を示しました。これは、ポリファーマシーによる他の薬剤のノイズに隠されることなく、ミラベグロン自体の影響が純粋に抽出された結果と考えられます。
発現時間分析:いつ生じるのか
薬剤を開始してから心房細動が報告されるまでの期間(TTO)を分析したところ、非常に重要な時間的パターンが見えてきました。全体として、心房細動の報告の80%以上が、投与開始から1年以内に集中していたのです。
Weibull (ワイブル)分布を用いた形状パラメータ(ベータ値)による解析(「副作用が、薬を飲み始めてからどのタイミングで起きやすいか」を判別するための指標を求めるもの)では、ミラベグロンのFAERSデータにおいてβ値が0.56(95%信頼区間 0.50から0.65)という値を示しました。このβ値が1を下回るパターンは、投与初期にイベントが集中して発生する「初期故障型(Early failure)」に分類されます。ソリフェナシンのFAERSデータも同様にβ値0.53を示し、初期のリスク監視が極めて重要であることを物語っています。具体的な中央値としては、ソリフェナシンが24日から66日、ミラベグロンが24日から89日と、数ヶ月以内に事象が発生する傾向が確認されました。
分子生物学的および薬理学的視点からの考察
なぜ同じ過活動膀胱治療薬の中で、これほどの差が出るのでしょうか。本論文では、薬剤の受容体選択性の違いが背景にある可能性に触れています。
β3作動薬であるミラベグロンとビベクロンの差は、その選択性に由来すると推測されます。
ミラベグロンはβ3受容体への親和性を持ちつつも、わずかながらβ1およびβ2受容体に対しても活性を示すことが知られています。心房にはβ1およびβ2受容体が存在しており、これらの意図しない刺激が心房の収縮力を増強させ、結果として心房細動を誘発する引き金になる可能性が指摘されています。
これに対し、ビベグロンはβ3受容体に対する選択性がより高く、心臓への影響が限定的であったことが、シグナルの欠如に繋がったと考えられます。→補足参照
一方、抗コリン薬であるソリフェナシンの場合、ムスカリン受容体遮断が自律神経系のバランスを変化させ、心拍数や心臓の電気生理学的特性に影響を与える可能性が考えられます。特に女性は、先天的にQT間隔が長く、薬剤誘発性の不整脈に対して脆弱であるという生物学的特性を持っており、これが女性層でのシグナル検出に寄与している可能性が示唆されました。
また、臨床現場においてミラベグロン(ベタニス)とソリフェナシン(ベシケア)を併用することがあります。単剤療法で十分な効果が得られない難治性の過活動膀胱患者に対し、異なるメカニズムを持つこれらの薬剤を組み合わせる「併用療法」は、有効な選択肢の一つとして確立されています。理論上、併用によって心房細動(AF)のリスクがさらに大きくなる可能性は否定できません。
明日からの臨床・実践に活かせる行動指針
本研究の成果は、明日からの診療や服薬指導に直結する重要な示唆を含んでいます。読者が明日から実践できる行動を以下にまとめます。
- 投与開始から1年、特に最初の3ヶ月を重点監視期間とする。心房細動の報告は投与初期に集中しています。新規導入後の数回の診察では、単に排尿症状の改善を確認するだけでなく、動悸、息切れ、めまいといった心房細動を示唆する症状の有無を必ず問診してください。
- 高リスク層(女性・高齢者)への個別化された注意。ソリフェナシンを高齢女性に開始する場合、あるいはミラベグロンを開始する場合には、心血管系の既往歴を再確認し、必要に応じて導入前後の心電図検査を検討してください。
- 患者教育の徹底。患者に対して「尿の薬」が「心臓」に影響する可能性があるとは、通常想像しにくいものです。「もし急に脈が速くなったり、胸がドキドキしたり、めまいを感じたりした場合は、すぐに相談してください」という一言を添えることが、重大な合併症の早期発見に繋がります。
- 薬剤の選択肢の再考。心血管リスクが高い患者においてβ3作動薬を選択する場合、本研究でシグナルが検出されなかったビベグロンを選択肢として優先的に検討する根拠の一つとなり得ます。
本研究の限界(Limitation)
本研究は自発報告データベースに基づく解析であるため、以下の限界があります。
まず、自発報告という性質上、過少報告や報告バイアスを完全に排除することはできません。また、分母となる総曝露人数が不明であるため、真の発現頻度や相対リスクを算出することは不可能です。
さらに、データベースには交絡因子(基礎疾患の詳細や喫煙歴、検査数値など)が不足しており、薬剤と心房細動の間の因果関係を確定させるものではなく、あくまで「仮説生成」の段階であることに留意する必要があります。
結論
本研究は、過活動膀胱治療薬、特にソリフェナシンとミラベグロンの使用が、実臨床において心房細動の報告シグナルと有意に関連していることを日米のビッグデータから明らかにしました。特に投与開始から1年以内の初期段階におけるリスクが浮き彫りとなったことは、臨床上の安全管理において極めて重要な知見です。私たちは、これらの薬剤がもたらす便益を享受しつつも、心臓という別の臓器が発する微細な悲鳴を見逃さないよう、常に高い警戒心を持って診療にあたる必要があります。
参考文献
Nagura K, Watanabe S, Watanabe T and Sagara H (2026) Atrial fibrillation signals associated with overactive bladder drugs across JADER and FAERS: disproportionality and time-to-onset analyses. Front. Pharmacol. 16:1700587. doi: 10.3389/fphar.2025.1700587
補足:β(ベータ)受容体
アドレナリン受容体の一種であるβ(ベータ)受容体は、全身のさまざまな組織に存在し、交感神経からの指令を受け取って「戦いか逃走か(闘争・逃走反応)」に備える重要な役割を担っています。
大きく分けて3つのサブタイプがあり、それぞれ「どこの臓器にあるか」と「どんな反応を起こすか」が明確に分かれています。
β1受容体:主に「心臓」と「腎臓」
β1受容体は、主にエネルギーを全身に送り出すためのアクセルの役割を果たします。
- 主な場所: 心臓(洞結節、房室結節、心筋)、腎臓(傍糸球体装置)。
- 役割(心臓): 心拍数を上げ、心筋の収縮力を強めます。これにより、一度に送り出す血液量(心拍出量)が増加します。
- 役割(腎臓): 血圧を上げるホルモンである「レニン」の放出を促します。
β2受容体:主に「平滑筋(気管支・血管)」
β2受容体は、主に「筋肉を緩める(弛緩させる)」ことで、活動に必要な酸素や栄養を取り込みやすくします。
- 主な場所: 肺(気管支)、血管(主に骨格筋の血管)、肝臓、膀胱(排尿筋)。
- 役割(肺): 気管支を広げ、酸素をより多く取り込めるようにします(気管支拡張)。
- 役割(血管・肝臓): 骨格筋への血流を増やし、肝臓では糖を作って血液中に放出(血糖値の上昇)させ、エネルギーを確保します。
- 役割(膀胱): 尿を溜めるために膀胱を緩めます。
β3受容体:主に「脂肪」と「膀胱」
β3受容体は、主に代謝やエネルギー消費、そして排尿管理に関わります。
- 主な場所: 脂肪組織、膀胱(排尿筋)。
- 役割(脂肪): 脂肪を分解してエネルギーを取り出したり(脂肪分解)、熱を発生させたりします(熱産生)。
- 役割(膀胱): 膀胱をリラックスさせ、尿を十分に溜められるようにします。これが過活動膀胱の治療における主要な標的です。
ミラベグロンで心臓の報告が多い理由
今回のご提示いただいた論文において、同じβ3作動薬でも「ミラベグロン(ベタニス)」で心房細動のシグナルが出やすく、「ビベグロン(ベオーバ)」で出にくかった理由は、これらの受容体への「選択性」の違いで説明できます。
- ミラベグロン: 本来の標的であるβ3だけでなく、わずかにβ1やβ2にも作用してしまいます(選択性が少し低い)。そのため、心臓にあるβ1受容体を意図せず刺激してしまい、心拍数の乱れや心房細動を引き起こす「引き金」になりやすいと考えられます。
- ビベグロン: β3受容体に対して非常に高い選択性を持っており、β1やβ2にはほとんど作用しません。そのため、心臓への影響を最小限に抑えられている可能性が高いことが示唆されています。
このように、どの受容体をどれくらい正確に刺激するかという「精密さ」が、薬の安全性に大きく関わっているのです。