はじめに:LDLとは何か、なぜ血管壁に入るのか
LDL(Low-Density Lipoprotein)は、肝臓で生成され、血中を通じて全身の細胞へコレステロールを供給するリポタンパク粒子です。直径22〜27nmの球状構造を持ち、その表面にはアポリポタンパクB-100(apoB-100)が一つ存在しています。コレステロール、リン脂質、トリグリセリドなどを含み、細胞膜構築やホルモン合成などに必要な脂質を運びます。
本来LDLは、血管内を循環するのみで、血管壁の中にはほとんど入りません。これは、内皮細胞が選択的透過バリアとして機能しているためです。しかし、一定の条件下でLDLはこのバリアを突破し、内皮下空間(intima)に蓄積し始めます。これが動脈硬化の出発点となるのです。
正常環境下におけるLDLの通過:選択的トランスサイトーシス
健康な血管内皮では、LDLは以下の選択的トランスポート経路によってごく少量が通過します。
Caveolin-1とカベオラ依存性トランスサイトーシス
Caveolin-1は内皮細胞膜に存在する50〜100nmの陥凹構造「カベオラ(caveolae)」を形成する膜タンパクです。この構造はLDLなどの大分子を小胞として取り込み、細胞内を経て反対側へ輸送する「トランスサイトーシス」を担います。これはエネルギー依存的で選択的なプロセスです。
SR-BIおよびALK1による選択的輸送
SR-BI(Scavenger Receptor Class B Type I)は、主にHDL由来のコレステロール逆輸送に関与する受容体ですが、内皮細胞でも発現しており、LDLも選択的に取り込み可能です。ALK1(Activin receptor-like kinase 1)はTGF-β/BMP経路に属する内皮細胞特異的受容体で、血管新生と透過性制御に関与します。これらはLDLの微量輸送に寄与しつつ、血管機能の維持に関わっています。
正常な処理と逆輸送
LDL粒子は、主に以下のような分子を運んでいます:
- コレステロールエステル(粒子中心部):細胞膜やステロイド合成の材料
- リン脂質、遊離コレステロール(粒子表層):膜構造の構成要素
- アポB-100:受容体との認識・取り込みに関与
- 微量の脂溶性ビタミン、酸化防御物質(例:ビタミンE)
内皮を通過したLDLの多くは、局所利用(細胞膜形成、脂質シグナル補助、細胞増殖・分化・恒常性維持など)に使われるか、HDLを介して再び肝臓へ戻る「逆輸送(reverse cholesterol transport)」に組み込まれます。
病的環境下でのLDL透過性亢進:二重バリアの破綻
LDLが病的に血管内皮下に侵入する際は、「トランスセルラー経路」と「パラセルラー経路」の両方が変化します。
パラセルラー経路の破綻
通常、LDLの大きさでは内皮細胞間のタイトジャンクション(tight junction)を通過できません。ところが以下の病的因子が関与すると、タイトジャンクションが緩んでしまい、このバリアが崩壊します:
- 高血糖:AGEs(終末糖化産物)がRAGE受容体を介してNF-κBを活性化し、ClaudinやOccludinの発現を抑制
- 高血圧:剪断応力によりタイトジャンクションの構造を破綻
- 炎症性サイトカイン(TNF-α, IL-1β):ZO-1のリン酸化異常や骨格再編成を誘導
- 酸化ストレス:ROS(活性酸素)によりバリア構造の損傷を引き起こす
結果として、パラセルラー経路(細胞間隙)を通じた「非選択的なLDL漏出」が起こります。
トランスサイトーシス経路の亢進
同様に、Caveolin-1やSR-BIの過剰発現やリン酸化、ALK1の活性化などによって、トランスサイトーシスの頻度も増加します。これは、血流の変化や局所炎症が細胞内輸送系を制御不能にしてしまうことによります。
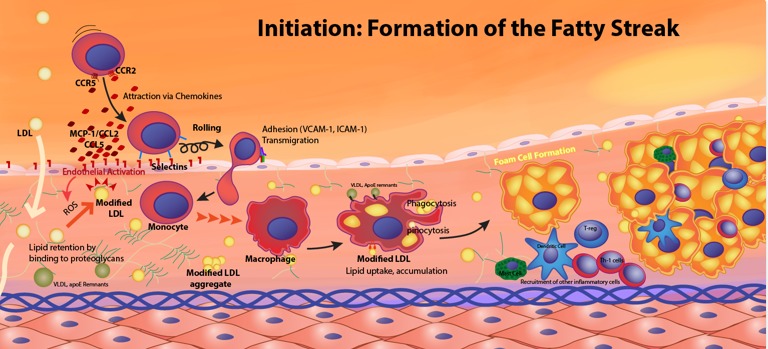
病的環境下で内皮下に到達したLDLの運命:プラーク形成の出発点
血管内皮を突破したLDLは、内皮下(intima)のプロテオグリカンと結合し「足止め」されます。この時点での運命は以下のようになります。
プロテオグリカンとの結合
LDL表面のapoB-100が、コンドロイチン硫酸やヘパラン硫酸などのPGと結合し、局所に滞留します。Skålénらの研究では、この「保持(retention)」こそが動脈硬化の初発イベントであることが明らかにされています。
酸化修飾と免疫応答
滞留時間が長くなると、ROSやMPOなどによりLDLは酸化されoxLDLになります。これにより、マクロファージがスカベンジャー受容体(CD36, SR-A)を介して取り込み、泡沫細胞(foam cell)へと変化します。
平滑筋細胞の遊走と線維性キャップ形成
進行した病変では、中膜から血管平滑筋細胞がintimaに遊走し、合成型に変化してコラーゲンを産生します。これが脂質核の周囲を覆い、プラークの安定性に関与します。
生理的LDL通過との違い:通過≠滞留≠病変
正常状態では、LDLは通過後に再利用・逆輸送され、蓄積も酸化も起こりません。病的状態では、「量の増加」と「環境の悪化(酸化・炎症)」によって、通過が滞留に変わり、病変へと進展します。
| 状態 | LDL通過量 | 酸化 | 滞留 | プラーク形成 |
|---|---|---|---|---|
| 正常状態 | 微量 | 少ない | ほぼなし | 起きない |
| 病的状態 | 増加 | 促進 | 起こる | 起こる |
臨床的意義:LDL透過性の制御は動脈硬化予防の核心
LDLの血管内皮下侵入を防ぐには、単にLDL濃度を下げるだけでなく、「内皮バリア機能の維持」も不可欠です。抗酸化作用を持つ食事や運動、血糖・血圧コントロールは、内皮機能の維持を通じて動脈硬化の予防に直接貢献します。
さらに近年、SR-BIやALK1の制御に着目した薬剤の研究も進行中であり、動脈硬化の初期病態を標的とする新しい治療戦略として期待されています。
結論
LDLが血管内皮下に侵入するプロセスは、極めて精緻に制御された生理的現象であり、その破綻が動脈硬化の第一歩です。トランスサイトーシスやパラセルラー透過といった分子機構は、血流、圧力、酸化、炎症といった多様な因子に応答して変化します。
この過程を理解することは、予防医学・治療介入の精度を高めるうえで不可欠です。LDLは「悪者」ではなく、環境次第で「代謝の支援者」にも「炎症の導火線」にもなり得る存在なのです。
参考文献
・Linton MRF, Yancey PG, Davies SS, et al. The Role of Lipids and Lipoproteins in Atherosclerosis. [Updated 2019 Jan 3]. In: Feingold KR, Anawalt B, Blackman MR, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK343489/
・Borén J, Chapman MJ, Krauss RM, Packard CJ, Bentzon JF, Binder CJ, Daemen MJ, Demer LL, Hegele RA, Nicholls SJ, Nordestgaard BG, Watts GF, Bruckert E, Fazio S, Ference BA, Graham I, Horton JD, Landmesser U, Laufs U, Masana L, Pasterkamp G, Raal FJ, Ray KK, Schunkert H, Taskinen MR, van de Sluis B, Wiklund O, Tokgozoglu L, Catapano AL, Ginsberg HN. Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2020 Jun 21;41(24):2313-2330. doi: 10.1093/eurheartj/ehz962. PMID: 32052833; PMCID: PMC7308544.