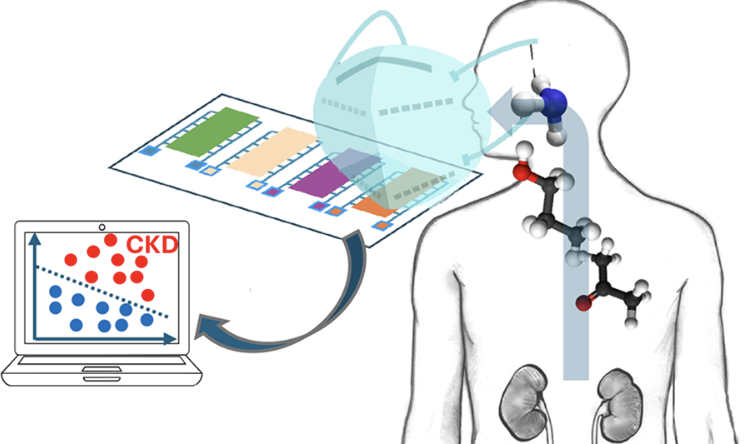
はじめに:腎疾患診断の非侵襲的アプローチの必要性
慢性腎臓病(chronic kidney disease:CKD)は、初期段階では症状に乏しく、進行すると人工透析などの腎代替療法や心血管疾患リスクの増加につながる重大な疾患です。世界人口の約10%がCKDに罹患していると推定され、特に高齢化が進む国々では早期診断の重要性が一層高まっています。しかし、既存の診断手段である血清クレアチニンやGFR測定は、採血やラボ設備を必要とし、一般市民が容易にアクセスできるものではありません。
このような背景のもと、本研究はFFP2マスクの内部に感応性ガスセンサーを組み込むことで、呼気分析を通じてCKDを簡便かつ非侵襲的に検出する新しい技術を提案しています。
センサーの構造と分子設計:ポルフィリンと導電性高分子の融合
本研究では、導電性高分子であるpoly(3,4-ethylenedioxythiophene) polystyrenesulfonate;PEDOT/PSSにポルフィリン誘導体をドープした材料をセンサー感応層として用いています。ポルフィリンは広範な配位化学を可能にする芳香環構造を有し、アンモニアやアルデヒド、アルコールなど多種の揮発性有機化合物(VOCs)に対して高い親和性を示します。
用いられたポルフィリンは以下の4種類です:
- H₂TPPS(スルホン酸基修飾ポルフィリン)
- MnTPPS(そのマンガン錯体)
- H₂TPyP(ピリジル基修飾ポルフィリン)
- MnTPyP(そのマンガン錯体)
これらは水溶性かつ導電性ポリマーと混合可能であり、分子間の水素結合、静電相互作用、配位結合といった多様な相互作用を通じて、VOCsに応答する電子的変化を引き起こします。
補足:私もよくわからないから、よりやさしく説明
呼気から病気を見つける“においセンサー”とは?
本研究では、「におい分子をキャッチする特別な材料」を使って、呼気に含まれる成分から慢性腎臓病(CKD)を見つける技術を開発しています。その材料の中で中心的な役割を果たしているのが、PEDOT/PSS(ペドット・ピーエスエス)という導電性高分子と、ポルフィリンという分子の組み合わせです。
PEDOT/PSSって何?
PEDOT/PSSは、「電気を通すプラスチック」のようなものです。センサーにこの物質を使うことで、呼気中の成分と反応したときに、電気の流れ方が変化するという仕組みを使っています。つまり「においで電気信号が変わる」=「反応した分子を検出できる」わけです。
ポルフィリンってどんな物質?
ポルフィリンは、ヘモグロビン(赤血球の成分)にも使われている特殊な環状構造をもつ分子です。この構造のすごいところは、
- 真ん中に金属イオンを入れられる
- 周りにさまざまな化学基(アンモニアやアルデヒドなど)と結びつけやすい
つまり、「特定の分子だけを引き寄せて捕まえる磁石のような性質」を持っています。
今回使われた4種類のポルフィリン
この研究では、性質の異なる4種類のポルフィリンを用いて、それぞれ異なる呼気中の物質に反応するように工夫しています。
| 名前 | 特徴 | 役割 |
|---|---|---|
| H₂TPPS | スルホン酸基で水に溶けやすく改良 | 極性のあるガス(アンモニアなど)に反応 |
| MnTPPS | 上のH₂TPPSの中心にマンガンを入れたもの | 酸化反応を促進しやすい、反応性UP |
| H₂TPyP | ピリジル基で他の化学物質と結びつきやすい | アルデヒドやアミンに選択的に反応 |
| MnTPyP | 上のH₂TPyPの中心にマンガンを入れたもの | 酸素と関わる化学変化にも対応可能 |
これらを導電性ポリマー(PEDOT/PSS)の中に混ぜて薄い膜にして、呼気中の「におい分子(VOCs)」が当たったときに電気の流れが変わるように作られています。
なぜ4種類も使うの?
それぞれのポルフィリンが異なるタイプの「におい成分」に反応するため、4種類を組み合わせることで、CKD特有の呼気の“においのパターン”をより正確に読み取れるのです。これはちょうど、犬の嗅覚がいろんな匂いを同時に嗅ぎ分けて、人間にはわからない情報を読み取っているようなものです。
補足のまとめ
このセンサーは、電気を通す高分子(PEDOT/PSS)に、においを選んで捕まえるポルフィリンを組み込んだことで、呼気中のごく微量な病気のサインを検出できるように設計されています。多種類のポルフィリンを使うことで、より高精度な病気の「においのパターン分析」が可能になっています。
デバイス構築と物理特性評価
センサーはPMMA基板上に銀電極をプリントし、そこにポルフィリン/PEDOT/PSS混合溶液を塗布することで作成されました。4つの異なるポルフィリンセンサーを配したアレイは、FFP2マスクの内側に埋め込まれ、呼気中の化合物に継続的に曝露される設計です。
SEMとEDX解析により、PEDOT/PSSおよびポルフィリンの均一なコーティングが確認され、導電特性も各センサーで良好な再現性を示しました。特にMn錯体はPEDOT/PSSのp型導電性に対して電子供与的に作用し、センサー抵抗を低下させることが確認されました。
感度と選択性:アンモニアおよび多様なVOCsの識別
代表的なVOCs(アンモニア、エタノール、プロパノール、アセトン、トリエチルアミン)に対して応答性を評価した結果、純粋なPEDOT/PSSに比べ、ポルフィリン添加により感度は最大9倍(H₂TPyPに対するアンモニア)に増加しました。また、Mn錯体を含むセンサーは1-プロパノールなどのアルコール類に対して高感度を示し、ポルフィリンの金属中心による特異的選択性が示唆されました。
PCAによる主成分分析では、濃度補正を行うことで各化合物がセンサーアレイ空間上で明確に分離され、センサーの交差選択性(combinatorial selectivity)が確保されていることが示されました。
CKDの定義(本研究での取り扱い)
- 定義の基準:
腎構造または機能の異常が3か月以上持続し、健康に影響を及ぼす状態 - 診断基準として用いた主要項目:
- eGFR < 60 mL/min/1.73 m²(推算糸球体濾過量の低下)
- 腎障害のマーカーの存在(以下のいずれか)
- アルブミン尿(30 mg/g Cr 以上)
- 尿沈渣異常
- 電解質異常(尿細管障害由来)
- 組織学的異常
- 画像診断での腎構造異常
- 腎移植歴
- 対象者のステージ分布(n=53):
- ステージ2(GFR ≒ 60–89):3名
- ステージ3a, 3b(GFR ≒ 30–59):26名
- ステージ4(GFR ≒ 15–29):15名
- ステージ5(GFR < 15):6名
呼気分析対象としてのCKD
CKD患者では、腎臓の代謝・排泄機能の低下により、以下のような揮発性化合物(VOCs)の蓄積が呼気中に確認されています:
- アンモニア(平均濃度:CKD群 34 ppm、対照群 2.9 ppm)
- トリメチルアミン
- ジメチルスルフィド
- アセトン、アルデヒド類など
これらは、CKDの定義に基づく腎機能障害の生理的帰結として発生するものであり、病態の定義と呼気成分の変化が密接に対応していることが、本研究の解析設計の背景にあります。
対象者の登録基準
・年齢:18~80歳
・CKD群はKDIGOガイドラインに基づき、ステージ2〜5が3〜6か月以内に確認された者
・対照群はCKD診断歴なし、腎機能正常、感染症・炎症疾患・悪性腫瘍の既往なし
臨床評価:CKD患者と健常者の識別性能
イタリアのTor Vergata病院で実施された臨床試験では、CKD患者53名と健常者48名を対象に、2種類の呼吸リズム(通常・早い呼吸)下でセンサー信号を取得しました。信号は連続ウェーブレット変換(CWT)により時間−周波数解析がなされ、最大強度と平均強度の比から8つの特徴量が抽出されました。
LDA(線形判別分析)による識別では、
- 真陽性率(感度):93.3%
- 真陰性率(特異度):86.7%
- 精度(Accuracy(正確度、全体の正答率)):90%
- AUC(ROC曲線下面積):0.94(テストデータ)
と極めて良好な診断性能が示されました。また、PCAによる分析により、CKDステージ(2~5)ごとにセンサー特徴量が有意に異なる傾向も確認されました(p < 0.001、ただしステージ4と5間ではp = 0.1)。
新規性と実践的意義
この研究の最大の新規性は、以下の点にあります:
- 呼気という非侵襲的な媒体を用いて、腎機能のスクリーニングを実現した点
- マスクという日常的な物品にセンサーを埋め込むことで、誰もが利用できるインターフェースを確保した点
- ポルフィリン×PEDOT/PSSによる分子選択性と印刷技術の融合により、使い捨て可能な安価な診断デバイスを実現した点
臨床応用としては、地域医療や薬局におけるスクリーニング用途、あるいは自己管理ツールとしての展開が考えられます。特にCKDの初期は無症候であるため、こうしたツールによって早期介入が可能となることは、医療コスト削減にもつながります。
具体的な将来のイメージ
論文の現在の形では研究レベルの計測器(ポータブル機器+PC)で解析していますが、将来的な一般応用を想定すると、
- センサー付きマスクを装着して数回深呼吸する
- スマートフォンアプリや小型表示装置と連携して結果を確認
- 「CKDの疑いあり」「正常」「再検査推奨」などの表示が可能に
という流れが実現可能とされています。
Limitation(限界)
- 本研究ではセンサーの種類が4つに限られており、感度や選択性の拡張にはさらなるセンサー増設が必要です。
- ステージ5の被験者数が6名と少数であり、CKD重症度の正確な分類には限界があります。
- 呼吸条件やマスクの密閉性により、センサー応答に個人差が生じうる点はさらなる標準化が必要です。
- 検査後のマスク廃棄管理や、家庭用機器としての衛生・品質管理面での課題も残されています。
おわりに
本研究は、分子レベルの設計思想と社会的ニーズが融合した、まさに「呼気による健康診断」の実現に向けたマイルストーンといえます。今後、より多様な疾患(糖尿病、肝疾患、感染症)への応用、センサーアレイの多点化、AIによる判定支援との連携が進めば、パーソナライズドヘルスケアの中核技術となる可能性を秘めています。
参考文献
Capuano, R., Allegra, V., Catini, A., Magna, G., Di Lauro, M., Marrone, G., Agresti, A., Pescetelli, S., Pieri, M., Paolesse, R., Bernardini, S., Noce, A., & Di Natale, C. (2025). Disposable Sensor Array Embedded in Facemasks for the Identification of Chronic Kidney Disease. ACS Sensors. https://doi.org/10.1021/acssensors.4c03227