はじめに
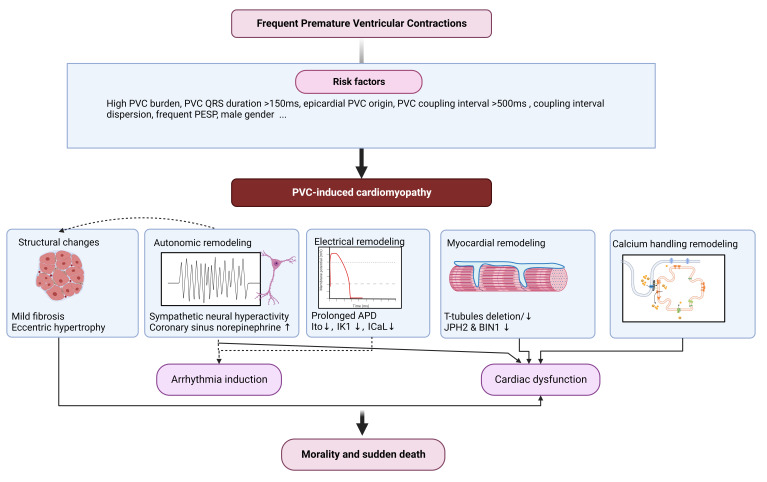
頻繁な心室性期外収縮(Premature Ventricular Contractions, PVCs)がもたらす心筋症(PVC誘発性心筋症:PVC-Induced Cardiomyopathy, PVICM)は、これまで軽視されてきた疾患概念でありながら、重要な臨床課題として注目を集めています。近年の研究により、PVICMのリスク因子、発症メカニズム、診断および治療法に関するデータが明らかになってきており、医療現場での介入の方向性が示されています。本稿では、PVICMの発症に関与する要因を分子生物学的視点を交えて解説し、患者さんが明日から実践可能なポイントも提案します。
PVCと心機能障害の関係性
PVCは心室からの異常な早期脱分極により生じる不整脈であり、心電図検査では多くは単独で出ますが、連続して出現することもあります。健常な成人でも24時間ホルター心電図で最大69%の人々に検出されることが知られていますが、大多数は無症候性で良性と考えられてきました。しかし、PVCの負荷が5%以上の場合、左室収縮機能低下のリスクが生じ、10–15%以上の場合、左室収縮機能低下のリスクが高まり、特に負荷が24%を超えると心筋症を引き起こす可能性が顕著に増加します。
PVICMの発症メカニズム:分子生物学的視点
1. 異常なカルシウムハンドリング(Calcium Handling)
心筋細胞内のカルシウム動態の異常は、PVICMの発症に中心的な役割を果たします。
以下のような要因が相互に作用し、カルシウムの不均衡を引き起こします。この結果、収縮力が低下し、拡張障害が生じます。また更なる不整脈を助長し得ます。
1. 筋小胞体(sarcoplasmic reticulum;SR)のカルシウム再取り込みの障害
- 原因:
- sarcoplasmic reticulum (SR) calcium ATPase(SERCA2a)の発現低下。
- phospholamban(PLN)の発現上昇。
- 結果:
- SERCA2aはSRへのカルシウムの再取り込みを担いますが、その活性が低下すると、細胞質内に過剰なカルシウムが残留します。
- PLNはSERCA2aの阻害因子として働き、リン酸化の不足がその抑制効果をさらに強めます。
影響:
- 細胞質内カルシウム濃度の増加により、心筋の弛緩が阻害され、収縮拡張サイクルが乱れます。
2. リアノジン受容体2(ryanodine receptor type 2;RyR2)の異常活性化
- 原因:
- RyR2はSRからカルシウムを放出するチャネルですが、カルシウム/カルモジュリン依存性プロテインキナーゼII(calcium/calmodulin-dependent protein kinase II alpha;CaMKII-α)の過剰活性化によりリン酸化されます。
- このリン酸化がRyR2の「漏れ」を引き起こします。
- 結果:
- SRから細胞質へ不適切なカルシウム放出が増加。
- 細胞内カルシウム濃度の不均衡が進行。
影響:
- 心筋細胞の収縮効率が低下。
- 不整脈の発生リスクが上昇。
3. 電位依存性カルシウムチャネル(Cav1.2)の異常
- 原因:
- Cav1.2チャネルの発現低下。
- T管からのCav1.2チャネルの再配置(dyad gapからの逸脱)。
- 結果:
- L型カルシウム電流(ICaL)が減少。
- CICR(カルシウム誘導性カルシウム放出)が効果的に機能せず、カルシウム信号が弱体化。
影響:
- SRへのカルシウム補充が不十分となり、収縮力がさらに低下。
- T管のリモデリングにより、細胞全体のカルシウムシグナルの同期性が崩れる。
4. CaMKIIの過剰活性化
- 原因:
- 細胞内カルシウム濃度の増加に伴い、CaMKII(calcium/calmodulin-dependent protein kinase II)の活性が亢進。
- 結果:
- SERCA2aやRyR2のリン酸化を介してカルシウム動態を制御しようとするが、その過剰な活性化が逆効果となり、カルシウム漏れやカルシウム蓄積を悪化させる。
影響:
- 収縮および拡張機能のさらなる低下。
- 長期的な心筋細胞の損傷およびリモデリングを助長。
5. ナトリウム-カルシウム交換系(sodium-calcium exchanger ;NCX)の異常
- 原因:
- NCXの発現増加が、細胞内カルシウム濃度を下げる補償メカニズムとして働く。
- 結果:
- NCXによるカルシウム排出がSRを介した再取り込みを上回るため、SR内のカルシウム貯蔵が枯渇。
- 細胞内ナトリウム濃度の上昇に伴い、膜電位が乱れる。
影響:
- 拡張期のカルシウム除去能力の低下。
- 長期的に不整脈や拡張機能障害を引き起こす。
6. ゲノムワイド関連研究(GWAS)の発見
- 原因:
- カルシウム処理タンパク質をコードする遺伝子の変異が確認されており、これがカルシウム恒常性に影響。
- 結果:
- ナトリウム電流の減少、伝導遅延、QRS持続時間の延長など、PVCの頻発と関連する変化が発生。
影響:
- 遺伝的要因がカルシウム処理異常の一因である可能性が示唆され、特定の患者群でPVICMの発症リスクが高まる。
イオンチャネルの変化と再分極異常
心筋細胞内のカルシウム動態の異常は、心室心筋細胞の活動電位時間を延長させ、以下のイオン電流密度の低下を引き起こします:
- 一過性外向き𝐾+電流(Ito)
- 内向き整流𝐾+電流(IK1)
- L型Ca2+電流(ICaL)
これらの変化は、関連するイオンチャネルサブユニットの発現低下を伴います。
結果:
これにより、悪性不整脈のリスクが高まる可能性があります。
心筋細胞の再分極が異常となり、興奮性が増加します。
異常なカルシウムハンドリングのまとめ
これらのメカニズムは相互に影響を及ぼし合い、カルシウムの流入、放出、再取り込み、および排出が全体的に不均衡な状態に陥ることで、PVICMの発症および進行が促進されます。以下のように、連鎖的な変化が観察されます:
- SR内カルシウム貯蔵量の減少。
- 細胞質内カルシウム濃度の異常な増加。
- 収縮・拡張サイクルの機能不全。
- 心筋リモデリングと心機能低下の進行。
2. 左室の同期不全(Dyssynchrony)
PVCは左室の同期性を乱し、心機能低下を引き起こします。特に、心室外膜起源のPVCや右心室由来のPVCは同期不全を悪化させ、心筋のリモデリングを進行させます。
3. 自律神経の関与(Autonomic Dysregulation)
PVC患者では交感神経活動の亢進が観察され、これは冠動脈洞静脈のノルエピネフリン濃度増加としても反映されます。動物モデルでは、心筋の過度な交感神経支配が心筋リモデリングを促進することが示されています。
4. 心筋リモデリング(Myocardial Remodeling)
心筋細胞の構造的変化として、
- T管の減少
- Zラインの配置異常
- 軽度の線維化 これらが確認されています。
これらの変化は、心筋の効率的な収縮・拡張を阻害し、長期的な心機能障害を引き起こします。
PVICMのリスク因子
1. PVC負荷
- 負荷が24%以上の場合、心機能障害のリスクが有意に増加します。
- 動物実験では、PVC負荷が25%を超えると心筋リモデリングが顕著に進行します。
2. QRS幅
- QRS幅が150msを超える場合、PVICMの発症リスクが80%増加します。
3. 性別
- 男性が女性よりもPVICMのリスクが高いとされています。
4. PVCの起源
- 心室外膜や右心室起源のPVCが特にリスクを高めます。
5. カップリング間隔
- PVCのカップリング間隔が500msを超える場合、左室リモデリングが促進されます。
診断と治療
1. 診断技術の進展
- **スピークルトラッキング法(Speckle Tracking)**による心筋構造の早期変化の検出。
- 心臓MRIによる線維化評価と機能評価。
2. 治療法
- カテーテルアブレーションは、92.5%の急性成功率と66-90%の長期成功率を持つ。
- **抗不整脈薬(AADs)**は、PVC負荷の軽減に有効だが、副作用への注意が必要。
実践のステップ
- PVCの負荷を評価するための検査
- 健康診断で異常が指摘された場合や動悸を感じる場合は、ホルター心電図検査を依頼し、PVCの頻度や負荷を確認。
- 早期診断と専門医への相談
- PVCの負荷が10%以上の場合、心エコー検査や心臓MRIを用いて心機能の詳細な評価を受け、必要に応じて専門医に相談。
- 生活習慣の見直し
- ストレス管理:瞑想やヨガを取り入れる。
- 適度な運動:週3–4回の有酸素運動を行う。
- 禁煙とアルコール制限:交感神経活動を抑えるために推奨される。
- カテーテルアブレーションの検討
- PVCの負荷が高く、症状が持続する場合、カテーテルアブレーションが有効な選択肢となる。
- 長期フォローアップの実施
- PVCの再発リスクがあるため、心電図や心エコー検査を定期的に行い、心機能を継続的に評価。
結論と展望
PVCは一般的な不整脈ですが、頻度が高い場合にはPVICMという深刻な病態に進行する可能性があります。カルシウム動態異常や左室同期不全、自律神経活動の変化が主な原因であり、これらを標的とした診断と治療が急務です。早期発見と適切な治療により、多くの患者が正常な心機能を回復できる可能性があります。臨床研究のさらなる進展が期待されます。
参考文献
Shen X, Zhu X, Zuo L, Liu X, Qin M. Mechanisms and Risk Factors for Premature Ventricular Contraction Induced Cardiomyopathy. Rev Cardiovasc Med. 2023;24(12):353. doi:10.31083/j.rcm2412353