はじめに
高密度リポタンパク質(High density lipoprotein;HDL)は長年「善玉コレステロール」として知られ、血中濃度が高いほど心血管疾患リスクが低いことが疫学的に示されてきました。しかし近年、HDLの「量」だけでなく「質」がその抗動脈硬化作用に決定的に重要であることが明らかになってきました。このレビュー論文は、HDLの多様なサブクラスが逆コレステロール輸送(reverse cholesterol transport: RCT)経路においてどのように機能分化しているかを解説しています。
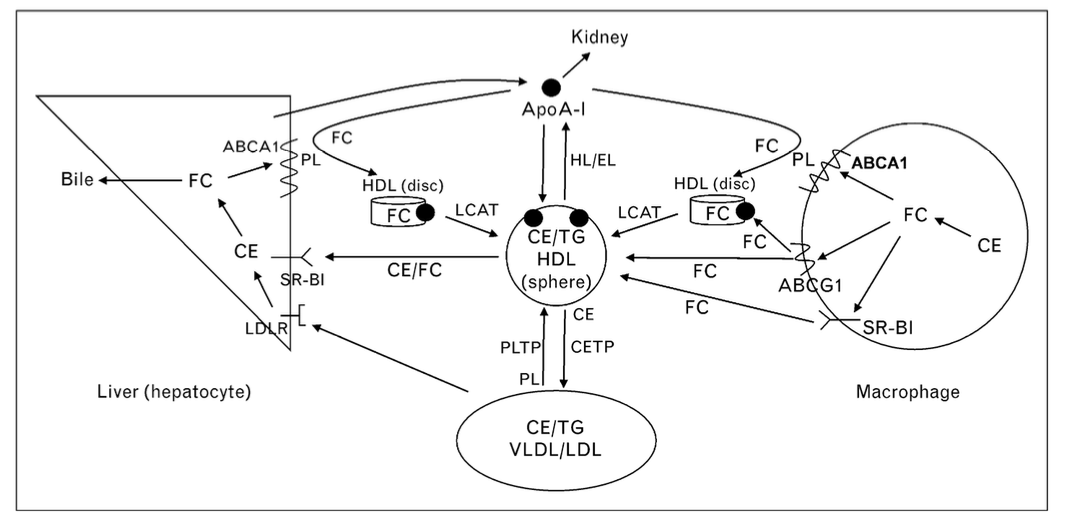
HDLが動脈壁のマクロファージから過剰なコレステロールを回収し、肝臓へ輸送するRCT経路は、HDLの抗動脈硬化作用の中核をなすメカニズムです。しかし興味深いことに、血中HDLコレステロール(HDL-C)値やアポリポ蛋白A-I(apoA-I)レベルは、必ずしもマクロファージからのコレステロール流出効率と相関しないことが指摘されています。この矛盾を解く鍵が、HDL粒子の「機能的多様性」にあります。
HDLの構造的多様性
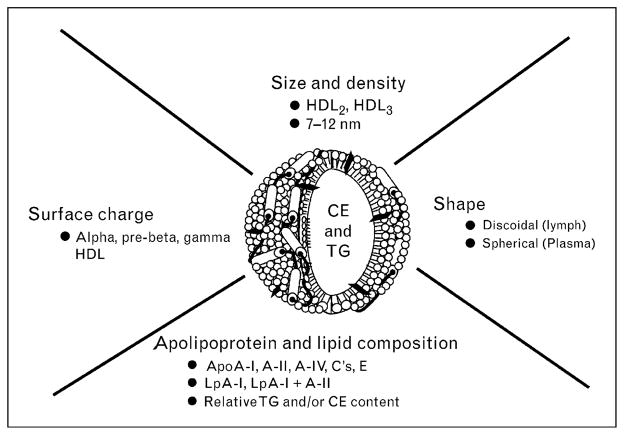
HDLは均一な粒子ではなく、サイズ、密度、電荷、アポリポタンパク構成により高度に異質性を示します。
密度に基づく分類では、HDL2(1.063–1.125 g/ml)とHDL3(1.125–1.210 g/ml)に大別され、さらに粒径の小さいHDL3c(7.2 nm)から大きなHDL2b(12.9 nm)までの分画が存在します。
また、電気泳動によってα-HDLとpreβ-HDLに分類され、前者が主要な血中HDLを占め、後者は約5%ですが、RCTの起点となる重要な分画です。
HDLはまた、アポリポタンパク質A-I(apoA-I)の有無により、apoA-Iのみを含むLpA-Iと、apoA-IとapoA-IIを含むLpA-I+A-IIにも分類されます。さらに、preβ-HDLはその構造上、主にapoA-Iとリン脂質から構成され、極少量のコレステロールしか含まれていません。
こちらも参考に。
HDLの生合成とリモデリング
HDL粒子の初期形成は、主に肝臓と小腸から分泌されるapoA-Iが、ATP-binding cassette transporter A1 (ABCA1) と相互作用することで始まります。この反応により、直径7〜20 nmのnascent HDLが形成されます。典型的には、9 nmまたは12 nmの円盤状粒子が主で、それぞれ2または3分子のapoA-Iを含みます。細胞内でapoMが共発現されると、粒子サイズが増加することも報告されています。
このnascent HDLは、lecithin-cholesterol acyltransferase(LCAT)の作用によりコレステロールエステル cholesteryl ester(CE)を生成し、球形の成熟HDLへと変化します。この過程では、CETP(cholesteryl ester transfer protein)やPLTP(phospholipid transfer protein)による脂質交換、肝性リパーゼによるトリアシルグリセロールの加水分解など、複数の因子が関与しています。HDLは、動的に粒径や組成を変化させながら機能を発揮する、きわめて可塑的な粒子であると言えます。
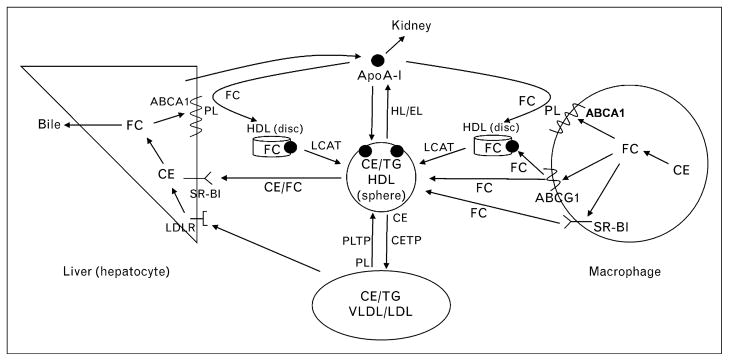
逆コレステロール輸送経路
逆コレステロール輸送経路(reverse cholesterol transport: RCT)は、末梢組織(特に動脈壁のマクロファージ)から余剰コレステロールを回収し、最終的に糞中へ排泄するプロセスです。この経路は主に以下の4つのコレステロール排出機構により開始されます。
- 水性拡散経路:細胞膜からHDLへの自由拡散による双方向性の輸送で、濃度勾配に依存します。この経路ではHDLサブクラス間で効率に大きな差はありません。
- ABCA1経路:preβ1-HDL(脂質乏しいapoA-I)との反応によりコレステロールとリン脂質が排出され、nascent(新生) HDLが生成されます。ABCA1のパルミトイル化修飾により膜局在性と機能が制御されていることが示されています。
- ABCG1経路:ABCG1は細胞膜の遊離コレステロールプールを増加させ、コレステロールがより容易に解離できるように再編成します。成熟HDL粒子への輸送を促進。HDL₂とHDL₃は同等の効率で受け入れます。
- SR-BI経路:HDLがSR-BIに結合することでコレステロール流出が促進されます。大きなHDL₂粒子は小さなHDL₃粒子よりもSR-BIへの親和性が高く、この経路での流出効率が優れています。
nascent HDL粒子に取り込まれたコレステロールは、血漿中でLCATによるエステル化やCETP/PLTPによるリモデリングを受けながら輸送され、最終的に肝臓に到達します。肝細胞はSR-BIを発現しており、HDLコレステロールの選択的取り込みを仲介します。興味深いことに、SR-BIは肝細胞の基底側膜と毛細胆管膜の両方に存在し、前者ではコレステロール流入を、後者では流出を促進します。胆汁へのコレステロール分泌速度はSR-BIの発現レベルと関連しています。

生体内RCT評価法と臨床的含意
RCTをin vivo(生体内)で評価するための有力なモデルとして、ラジオラベル化したマクロファージをマウス腹腔内に注入し、48時間後に血漿、肝、糞中の放射活性を測定する系があります。このモデルにより、以下の知見が得られました。
- apoA-IやCETPの過剰発現はRCTを促進。
- LCATの過剰発現はHDL-Cを増加させるが、RCTへの寄与は限定的です。
- PLTPの全身性過剰発現はRCTを阻害しますが、マクロファージ特異的発現では影響が見られません。
特にABCA1およびABCG1の欠損マクロファージでは、RCTが著明に抑制されることが示され、これらのトランスポーターがRCTにおける中核的役割を担っていることが実証されました。
血清流出能とHDLの質
血中HDL-C濃度やapoA-I量とRCT効率との相関は低く、RCTに最も影響を与えるのは、HDLのサブフラクション組成です。とりわけpreβ1-HDLの比率が高い血清は、ABCA1経路を介したコレステロール排出能が高いことが示されました。すなわち、HDLの「質」がその機能を規定しており、臨床的にはHDLサブフラクションのプロファイルが重要なバイオマーカーとなり得ます。
臨床的意義と将来展望
HDLの抗動脈硬化作用は、単に血中HDL-Cレベルによってではなく、HDLサブクラスの機能性によって規定されます。RCTにおいては、コレステロールがこの経路を通過する速度が重要であり、特定のタイプのHDL粒子の寄与がより明確に定義されつつあります。
動脈壁のマクロファージからapoA-IへのABCA1を介したコレステロール流出は、炎症を抑制する効果もあります。動脈内膜の平滑筋泡沫細胞ではABCA1活性が低下していることから、この輸送体が動脈硬化防止に重要な役割を果たしていることがわかります。
今後のHDLベースの治療法開発には、HDLサブクラスの機能性に関する知識の深化と、ヒトにおけるRCTを確実に測定する手段の確立が不可欠です。特に、HDLサブクラス分布や機能性を評価することが、HDLレベルを上昇させる介入を考える上で重要になってくるでしょう。
参考文献
Rothblat GH, Phillips MC. High-density lipoprotein heterogeneity and function in reverse cholesterol transport. Curr Opin Lipidol. 2010 Jun;21(3):229–238. doi:10.1097/MOL.0b013e328339f90a.