はじめに:HDLの多面的な役割
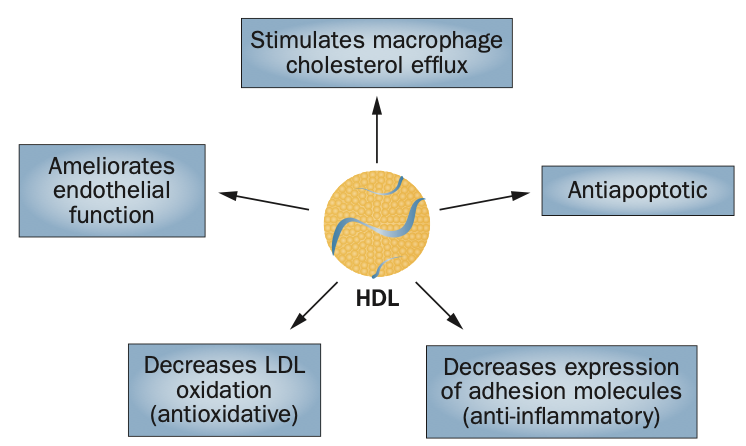
高密度リポ蛋白(High density lipoprotein;HDL)は従来、「善玉コレステロール」として知られ、動脈硬化に対する保護作用を持つと考えられてきました。HDL粒子とその主要な構成タンパク質であるアポリポ蛋白A-I(apoA-I)には、以下のような多様な抗動脈硬化作用があります。
- マクロファージからのコレステロール流出促進:ATP結合カセット輸送体A1(ABCA1)とG1(ABCG1)を介した逆コレステロール輸送
- 内皮機能改善:一酸化窒素(NO)産生促進による血管拡張作用
- 抗炎症作用:内皮細胞上の接着分子発現抑制
- 抗酸化作用:低密度リポ蛋白(LDL)酸化抑制
- 抗アポトーシス作用:PI3K/Akt経路の活性化とBcl-Xタンパク質のアップレギュレーション
ところが近年、「HDLコレステロール(HDL-C)」の量が正常または高値であっても、その質的な機能が損なわれている状態、すなわち「機能不全HDL(dysfunctional HDL)」が動脈硬化のリスクを高めることが明らかとなってきました。この機能不全HDLは、抗炎症性タンパク質の減少と炎症性タンパク質の増加によって特徴づけられます。
機能不全HDLの分子メカニズム
ミエロペルオキシダーゼによるHDLの修飾
動脈硬化巣に豊富に存在するミエロペルオキシダーゼ(MPO)は、apoA-Iの特定の残基を酸化およびニトロシル化することでHDLを機能不全にします。具体的には、以下のような修飾が確認されています。
- チロシン192 (Tyr192)の塩素化:ABCA1依存性コレステロール流出を障害
- メチオニン148 (Met148)の酸化:LCAT活性を阻害
- トリプトファン残基の酸化:ABCA1との相互作用を妨害
臨床研究では、安定冠動脈疾患患者や急性冠症候群(ACS)患者のHDLでは、これらの修飾が健常者と比べて有意に増加しています。例えば、冠動脈プラーク中のHDLは、血漿HDLと比べて3-クロロチロシンと3-ニトロチロシンの濃度が顕著に高いことが報告されています。
急性期反応によるHDL組成の変化
炎症時にはHDLの組成が大きく変化します。急性期反応では以下のような変化が観察されます。
- タンパク質組成の変化:
・セルロプラスミンと血清アミロイドA(SAA)の増加(最大1000倍)
・apoA-I、パラオキソナーゼ(PON)、血小板活性化因子アセチルヒドロラーゼ(PAF-AH)の減少
・アポC-IIIの存在 - 脂質組成の変化:
・リン脂質の酸化
・トリグリセリドの増加(約42%)
・コレステロールエステルの減少
この変化により、HDLは抗炎症性から促炎症性へと性質を転換します。
冠動脈疾患の患者群(HDL-C 57±13 mg/dL)のHDL炎症指数は1.38±0.91であり、健常群(HDL-C 64±6 mg/dL)の0.38±0.14に比して有意に高い値を示しました(P<0.001)。これは、HDLの抗炎症機能が失われ、逆に単球遊走を促進する「プロ炎症型HDL」となっていることを意味します。
HDL-C値が正常であっても、HDLの機能が損なわれているケースが存在するのです。
機能不全HDLの臨床的意義
心血管リスクとの関連
機能不全HDLは以下のような機序で心血管リスクを増加させます。
- コレステロール流出能の低下:
・ABCA1を介したマクロファージからのコレステロール流出が最大40%減少
・小さなHDL粒子(HDL-VS)の機能障害が特に顕著
- 内皮機能障害:
・内皮細胞のNO産生能が最大35%低下
・酸化ストレスの増加
- 炎症促進:
・NF-κB経路の活性化
・接着分子(ICAM-1、VCAM-1)の発現増加
Dallas Heart Study(n=2,924)では、マクロファージコレステロール流出能が最高四分位の人は最低四分位の人に比べて、心血管イベントリスクが67%低いことが報告されています。
特定疾患におけるHDL機能不全
2型糖尿病や喫煙は、HDLの機能障害を促進する重要な因子です。糖尿病ではHDLの糖化、酸化、トリグリセリド富化が進行し、apoA-Iの構造変化やPON1の減少を介して抗酸化能が失われます。また、喫煙者ではHDL中のスフィンゴミエリン比が上昇し、膜剛性が増すことで酸化リン脂質の除去能が低下します。
- 糖尿病:
・HDL粒子が小型化(直径約8.5nm→7.8nm)
・スフィンゴミエリン/ホスファチジルコリン比の増加(約1.5倍)
・抗酸化能が最大50%低下
- 喫煙:
・HDL3粒子の抗酸化能低下
・HDL2粒子のトリグリセリド含量増加(約25%)
・アセチルLDL取り込み抑制能の低下
治療的アプローチ
機能不全HDLを修復する試みとして、生活習慣改善や薬剤介入が注目されています。
生活習慣介入
食事と運動:
- メタボリックシンドローム患者22名を対象とした研究では、短期間の食事・運動介入により、モノサイト走化性が1.19から0.94へと有意に改善(P<0.05)
- 飽和脂肪酸の摂取はHDLの抗炎症作用を減弱
減量手術:
- 34名の肥満女性において、ルーワイ胃バイパス術後6ヶ月で20%の減量
- HDL2(HDL-L)サブフラクションが42%増加(P<0.01)
- SCARB1を介したコレステロール流出が58%増加(P<0.001)
薬物療法
スタチンやナイアシン、CETP阻害薬などの薬剤は、必ずしも一貫してHDL機能を改善するとは限りません。たとえば、ナイアシンはHDL-Cを増加させる一方で、statin併用時にはその効果が減弱し、機能改善が限定的であることが臨床試験で示されました(AIM-HIGH試験、HPS2-THRIVE試験)。
明日から実践できるHDL機能改善策
- 抗炎症食の採用:
・オメガ3脂肪酸豊富な食品(魚、亜麻仁油)を積極的に摂取
・飽和脂肪酸の摂取を控え、不飽和脂肪酸に置き換え
- 有酸素運動の習慣化:
・週に150分以上の中等度運動(速歩きなど)を実施
・インスリン感受性を高め、HDLの質的改善を促す
- 禁煙:
・喫煙はHDLの抗酸化能を低下させるため、完全な禁煙を目指す
・電子タバコもHDL機能に悪影響を及ぼす可能性あり
- 血糖コントロール:
・食後高血糖を防ぐため、低GI食品を選択
・適正な体重維持(BMI 18.5-24.9を目標)
- 酸化ストレス対策:
・抗酸化物質(ビタミンC、E、ポリフェノール)をバランスよく摂取
・過度のアルコール摂取を避ける
おわりに
HDLは「量」よりも「質」が問われる時代に入っています。抗炎症作用やコレステロール排出能といった機能的側面を明確に評価し、個々の患者に適したリスク評価と介入戦略を講じることが、動脈硬化性疾患の予防・管理においてますます重要になってきます。明日からの診療に活かすべきは、HDL-C値のみに頼らず、炎症や酸化の背景を視野に入れた包括的評価への転換です。
参考文献
Rosenson, R. S., Brewer, H. B., Ansell, B. J., Barter, P., Chapman, M. J., Heinecke, J. W., … & Webb, N. R. (2015). Dysfunctional HDL and atherosclerotic cardiovascular disease. Nature Reviews Cardiology, advance online publication. doi:10.1038/nrcardio.2015.124