はじめに
アルコールと心臓の関係については古くから議論されてきました。適量の飲酒は心血管リスクを低減する可能性が示唆されていますが、一方で過度な飲酒が心房細動(AF)を誘発することも広く知られています。特に「ホリデーハート症候群(Holiday Heart Syndrome;HHS)」は、心疾患のない健康な人が過度の飲酒後に突然AFを発症する現象を指します。本稿では、2025年に発表されたAlvaradoらによる文献レビューをもとに、HHSの病態生理学的メカニズム、疫学データ、臨床的意義について解説します。
ホリデーハート症候群とは
HHSは、1978年にEttingerらによって初めて報告された概念です。彼らは、大量のアルコール摂取後にAFを発症するケースが多いことを指摘しました。特に、年末年始や祝祭日のように短期間で大量の飲酒をする機会に発生しやすいことから、この名称が付けられました。
現在の定義では、「5杯以上(男性)または4杯以上(女性)のアルコールを2時間以内に摂取すること」を大量飲酒(binge drinking)とし、これがAFを引き起こすと考えられています。日本においては、厚生労働省は純アルコール60g以上の飲酒を大量飲酒としています。WHOのデータによると、世界の大量飲酒の有病率は18.2%であり、アメリカでは成人の53%が定期的に飲酒をしており、そのうち44%が大量飲酒の経験があると報告されています。
HHSの疫学データ
Alvaradoらのレビューでは、2024年8月までのPubMedとCochraneデータベースを用いて、11の研究を選定しました。これらの研究は、大量飲酒とAF発症の関連を調査したもので、いずれも急性アルコール摂取、大量飲酒がAFリスクを増加させることを示しています。例えば、
- Larssonら(2014)のコホート研究では、15杯/週以上の飲酒をする人はAFのリスクが29%増加することが報告されています。
- Tuら(2022)の研究では、週5杯以下の適量飲酒でAFリスクが低減する一方で、それ以上の飲酒で急激にリスクが上昇するJカーブ関係が示唆されました。
- Voskoboinikら(2022)は、8.3±3.1杯の大量飲酒後24時間以内にAFが発症しやすいことを確認しました。
これらの結果から、短時間に多量のアルコールを摂取することがAF発症にとって強力なリスク因子であることが明らかになっています。
HHSの病態生理学的メカニズム
交感神経の活性化と迷走神経の抑制
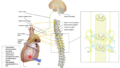
アルコール摂取は交感神経の活性化と迷走神経の抑制を引き起こし、心拍変動(HRV)の増加を伴う自律神経の不均衡を生じます。
- アルコール摂取後、ノルエピネフリン(NE)とカテコールアミンが放出され、心拍数が増加します。
- 心房筋のβ1アドレナリン受容体→アデニル酸シクラーゼ(AC)活性化→cAMP増加→プロテインキナーゼA(PKA)やカルシウム/カルモジュリン依存性キナーゼII(CaMKII)を介してT型カルシウムチャネル(TCC)機能促進、さらに転写因子CREB(cAMP response element-binding protein)の活性化によるTCCの遺伝子発現上昇。これにより、心房内での異常興奮性が増し、AFの発症リスクが高まります。
- この経路により、交感神経刺激は即時的なTCCの活性化(チャネルの開口促進)だけでなく、長期的なTCCの発現増加(遺伝子発現の上昇)をもたらす可能性があります。
- TCC(特にCav3.1, Cav3.2)は、通常は胎児期や新生児の心筋で高く発現し、成人の通常の心房・心室筋では発現が低いです。 しかし、成人の肺静脈心筋(PV cardiomyocytes)ではTCCが比較的多く発現しており、異常な興奮性をもたらす可能性があります(Chen et al., 2004)。
- また、心筋肥大、心不全、心筋梗塞後のリモデリングなどでTCCの再発現が報告されています。
T型カルシウムチャネルのアップレギュレーション
最近の研究では、交感神経刺激とは異なるメカニズムにより、T型カルシウムチャネル(T-type Calcium Channel, TCC)の活性化が心房異常興奮を引き起こす可能性が指摘されています。Wangら(2020)の研究では、アルコールがNFAT/PKC/GSK3βシグナルカスケードを介してCav3.1およびCav3.2(TCCを構成する主要なα1サブユニットであり、心筋や神経細胞の興奮性調節に関与)の発現を増加させることが示されました。
NFAT/PKC/GSK3β経路の概要
- アルコール代謝産物(アセトアルデヒド)が細胞内シグナルを活性化し、PKC(Protein Kinase C)のリン酸化を促進する。
- PKCの活性化がGSK3β(Glycogen Synthase Kinase 3β)をリン酸化し、その活性を抑制する。
- GSK3βの抑制により、NFAT(Nuclear Factor of Activated T-cells)の核内移行が促進され、TCC遺伝子の転写が増加する。
- TCCの増加は、活動電位の閾値を下げ、心房の異常興奮を促進し、AFを発症しやすくします。
- 特に、肺静脈周囲の異所性ペースメーカー活動が増加し、AFのトリガーとなります。
心房の電気的不安定性と構造変化
- アルコールは心房筋の活動電位の持続時間を短縮し、再分極異常やリエントリー(再侵入)回路の形成を助長します。
- TCCの活性化により心房の異所性興奮が増加し、AFが持続しやすくなることが示されています。
- 大量飲酒は、左心房の駆出率を低下させるなど、一時的な心房構造の変化を引き起こすことが報告されています。Richら(1985年)の研究では、AF発症後の心エコー検査で有意な心房容積や心室機能の変化は認められませんでしたが、左心房の機械的機能障害が観察されました。
HHSの診断と管理
診断
HHSは、大量飲酒後のAF発症という特徴的な病歴に基づいて診断されます。以下の検査が有用です。
- 心電図(ECG):AFやその他の頻脈性不整脈を確認
- 血液検査:電解質異常やアルコール代謝産物を評価
治療と予防
HHSの治療
HHSの治療は基本的にアルコール摂取の中止、禁酒です。
- AFの多くは24時間以内に自然回復します。
- AFが持続する場合、β遮断薬やカルシウム拮抗薬によるレートコントロールが推奨されます。
- 高リスク患者では、CHA₂DS₂-VAScスコアを用いて抗凝固療法の適用を検討します。
HHSの予防
予防策として、
- 1回の飲酒量を減らす
- 交感神経刺激を抑えるために、飲酒後の激しい運動を避ける
- 心血管リスクのある患者には節酒または禁酒を推奨する
AFのリスクが高い患者に対しては、個別化されたリスク評価を行い、アルコール摂取量を制限するか、完全に断つことを推奨します。特に、既存の心血管疾患を持つ患者や、AFの既往歴がある患者に対しては、アルコール摂取を控えることが重要です。
公衆衛生へのアプローチ
HHSの予防には、公衆衛生キャンペーンを通じてアルコール摂取のリスクを広く知らせることが重要です。特に、若年層や健康な個人に対して、大量飲酒の危険性を啓発することが求められます。
研究の限界と今後の課題
Alvaradoらのレビューは、HHSに関する重要な知見を提供していますが、いくつかの限界も指摘されています。まず、研究デザインや対象集団の異質性により、メタアナリシスが困難であることが挙げられます。また、アルコール摂取量の自己報告に依存しているため、報告バイアスが生じる可能性があります。さらに、併存疾患やライフスタイル要因が十分に考慮されていないため、アルコールの影響を過小評価または過大評価している可能性があります。
今後の研究では、大規模な前向きコホート研究を通じて、アルコール摂取パターンとAF発症の関連を長期的に追跡することが求められます。また、高リスク集団(高血圧、糖尿病、構造的心疾患を持つ患者)を対象とした研究を通じて、アルコールと併存疾患の相乗効果を明らかにすることが重要です。
まとめ
ホリデーハート症候群 Holiday Heart Syndrome (HHS) は、短期間の過度の飲酒によって心房細動(AF)が誘発される現象であり、その病態には交感神経の活性化、T型カルシウムチャネルのアップレギュレーション、心房の電気的不安定性、一時的な心房構造の変化が関与しています。健康な人でも大量飲酒がAFのリスクを高めることが明らかになっており、飲酒習慣の見直しが重要です。アルコール摂取の中止が最も重要な管理策であり、公衆衛生キャンペーンや個別化されたリスク評価を通じて、AFの発症を予防することが求められます。
参考文献
・Alvarado J, Zuniga P, Stringer I, et al. (February 28, 2025) Holiday Heart Syndrome: A Literature Review. Cureus 17(2): e79816. DOI 10.7759/cureus.79816
・Wang Y, Morishima M, Li D, Takahashi N, Saikawa T, Nattel S, Ono K. Binge Alcohol Exposure Triggers Atrial Fibrillation Through T-Type Ca2+ Channel Upregulation via Protein Kinase C (PKC) / Glycogen Synthesis Kinase 3β (GSK3β) / Nuclear Factor of Activated T-Cells (NFAT) Signaling - An Experimental Account of Holiday Heart Syndrome. Circ J. 2020 Oct 23;84(11):1931-1940. doi: 10.1253/circj.CJ-20-0288. Epub 2020 Oct 7. PMID: 33028764.