はじめに
アテローム性動脈硬化性心疾患(ASCVD)の予防において、HMG-CoA還元酵素阻害薬、いわゆるスタチンは現代医学における最強の武器の一つです。LDLコレステロールを約38.7 mg/dL(1 mmol/L)低下させるごとに主要な血管イベントを約4分の1減少させるというその圧倒的なエビデンスは、揺るぎないものとなっています。
しかし、長年この輝かしい功績の影で議論されてきたのが、スタチン投与による新規糖尿病(new-onset diabetes;NOD)の発症リスクです。
これまでのメタ解析では、スタチンが糖尿病リスクを約10%から12%高める可能性が示唆されてきましたが、その詳細なメカニズム、発症のタイミング、あるいはどのようなリスク層が真に脆弱であるのかについては、集計データのみに頼る従来の手法では限界がありました。
本稿では、2024年にLancet Diabetes & Endocrinology誌に掲載された、コレステロール・トリートメント・トライアリスト(Cholesterol Treatment Trialists’ ; CTT)コラボレーションによる最新の個別患者データ(IPD)メタ解析をもとに、スタチンと血糖代謝の複雑な関係を解き明かしていきます。
研究デザインと新規性:個別患者データが解き明かす究極の解析
本研究の最大の特徴は、従来の要約統計量を用いたメタ解析ではなく、各参加者の個別の臨床経過を直接統合して解析するIPDメタ解析(Individual Participant Data Meta-analysis:個別患者データメタ解析)であるという点にあります。これにより、従来の解析では不可能だった「個人の血糖値の変化」や「診断タイミングの精査」が可能となりました。
P(対象):2年以上の追跡期間と1000人以上の参加者を持つ、スタチン療法の無作為化二重盲検対照試験に参加した参加者。
スタチン対プラセボの比較を行った19試験(12万3940人、追跡期間中央値4.3年)と、スタチンの強度を比較した4試験(3万724人、追跡期間中央値4.9年)
I(介入):スタチン投与(低・中強度、または高強度)。
C(比較):プラセボ、またはより低強度のスタチン。
E/O(評価項目):新規糖尿病の発症(空腹時血糖値 126 mg/dL以上、随時血糖値 200 mg/dL以上、HbA1c 6.5%以上、または糖尿病関連の有害事象・新規薬剤開始)および、既存糖尿病患者における血糖悪化。
IPDメタ解析とは、それぞれの臨床試験に参加した一人ひとりの患者の生データ(RAWデータ)を各研究者から直接提供してもらい、それらを巨大な一つのデータベースとして統合して、改めて解析をやり直す手法です。
IPDを用いることで、ベースラインの血糖状態に応じた層別化や、時間軸に沿ったリスクの推移をかつてない精度で評価することが可能となったのが、本研究の最大の新規性です。
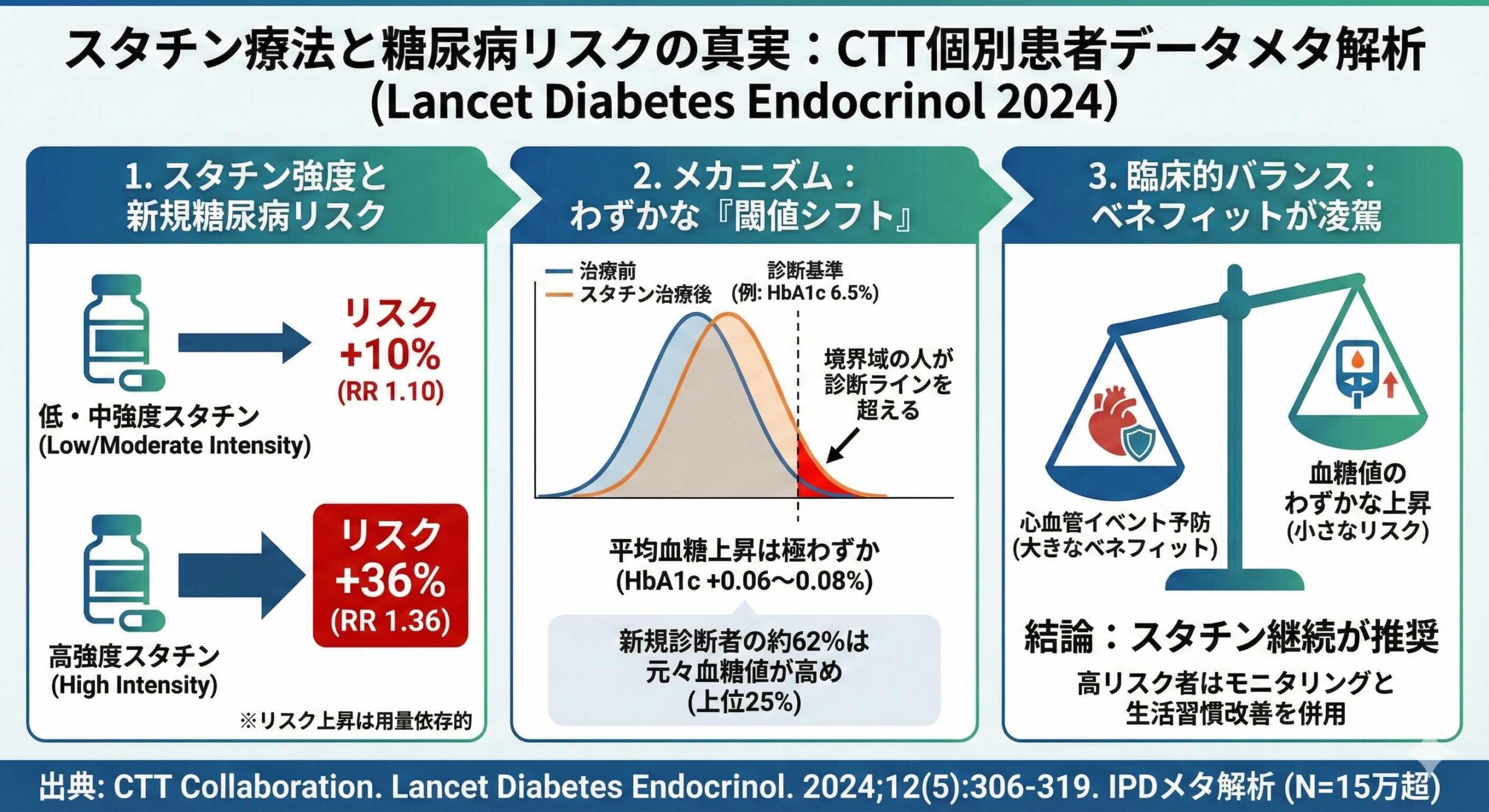
スタチン強度と糖尿病リスク:10%と36%の乖離が示すもの
解析の結果、スタチンによる糖尿病発症リスクは、その強度に強く依存することが浮き彫りになりました。
低強度または中強度のスタチン投与群では、プラセボ群と比較して新規糖尿病の発症リスクは10%上昇しました(率比 RR 1.10、95%信頼区間 1.04から1.16)。具体的には、スタチン群で年率1.3%の発症に対し、プラセボ群では1.2%でした。
これに対し、高強度のスタチン投与群では、リスクの上昇幅は36%へと大きく跳ね上がりました(RR 1.36、95%信頼区間 1.25から1.48)。
しかし、この36%という数字の解釈には注意が必要です。高強度スタチンの試験におけるプラセボ群の発症率は年3.5%と、中強度試験の1.2%よりも顕著に高くなっていました。この背景には、高強度スタチンの代表的試験であるJUPITER試験などで、HbA1cの測定が極めて頻回に行われていたという測定頻度の差が含まれています。実際、生化学的な診断基準を除外して臨床的な診断や薬剤の開始のみで評価すると、高強度スタチンにおけるリスク上昇の相対的な大きさは中強度スタチンとより近いものとなります。つまり、スタチンそのものが劇的に病態を悪化させているというよりは、境界線上にいる人々を診断基準の向こう側へわずかに押し出す力が、強度に応じて強まっていることを示唆しています。
閾値シフトの正体:なぜ新規と診断されるのか
本研究が提示した最も衝撃的、かつ臨床的に納得感のある知見は、スタチンが新規に糖尿病を引き起こすのではなく、既存の血糖値をわずかに上方にシフトさせているに過ぎないという点です。
非糖尿病患者において、スタチン投与による平均血糖値の上昇は、低・中強度、高強度のいずれにおいても約0.7 mg/dL(0.04 mmol/L)程度でした。また、HbA1cの上昇幅は低・中強度で0.06%、高強度で0.08%という、極めて微小な変化にとどまっています。では、なぜ糖尿病の新規診断が増えるのでしょうか。その答えは、ベースラインの血糖値分布にあります。新規糖尿病と診断された症例の約62%は、治療開始前の時点で既に血糖値がベースライン分布の最上位4分の1(いわゆる糖尿病予備軍)に位置していた人々でした。
これは集団全体の血糖値がわずかに右側(高値側)へシフトすることで、診断基準である6.5%という閾値を越える人々が続出するという現象を説明しています。分子生物学的な視点で見れば、HMG-CoA還元酵素の阻害がインスリン感受性やインスリン分泌に微弱な影響を与えている可能性は否定できませんが、その影響は破壊的なものではなく、あくまで「わずかな後押し」であると言えます。
体重増加と代謝的寄与:その寄与度は限定的か
スタチンによる糖尿病リスクの背景として、しばしば体重増加が指摘されます。本解析においても、スタチン投与群ではプラセボ群と比較して、1年時点で0.16 kg、最終測定時点で0.30 kgの有意な体重増加が認められました。
しかし、この程度の体重増加が糖尿病発症の主因であるとは考えにくいというのが、本研究の結論です。過去の生活習慣介入試験では、2.45 kgから5.6 kgといった大幅な体重減少が糖尿病リスクを30%から58%低下させています。これらと比較すると、スタチンによる0.30 kgという体重変化がもたらす代謝的負荷は、観察された糖尿病リスク上昇のごく一部を説明するに過ぎないと考えられます。スタチンがもたらす血糖上昇は、体重増加という間接的な要因よりも、細胞レベルでの直接的な代謝変容に依存している可能性が高いと考えられます。
糖尿病合併例における血糖コントロールの悪化:その実態
すでに糖尿病と診断されている患者におけるスタチンの影響も、新規発症と同様の傾向を示しました。低・中強度のスタチンは血糖コントロール悪化のリスクを10%高め、高強度スタチンでは24%高めることが示されました。
具体的には、平均血糖値の上昇幅は低・中強度で約2.2 mg/dL、高強度で約4.0 mg/dLであり、HbA1cの上昇幅は低・中強度で0.09%、高強度で0.24%でした。新規発症の場合よりもやや大きな上昇が見られますが、これも臨床的には血糖降下薬の微調整で対応可能な範囲です。興味深いことに、この血糖悪化の影響は投与初期数年でより顕著に見られ、長期追跡ではその差が収束していく傾向も認められました。これは、臨床現場で血糖値の変動が適切にモニタリングされ、治療が最適化されていることを反映している可能性があります。
臨床現場への提言:明日からの診療にどう活かすべきか
本研究の結論は、スタチンの有用性を否定するものではなく、むしろその安全性をより精密なデータで補強するものです。医療従事者が明日からの診療で実践すべき行動指針は、以下の3点に集約されます。
第一に、スタチンを開始しても糖尿病の「発症」を過度に恐れる必要はないという事実を共有することです。新規に診断される糖尿病の多くは、スタチンが病気を作ったのではなく、元々境界線上にいた患者の状態をわずか0.1%にも満たないHbA1cの上昇によって可視化したに過ぎません。
第二に、ベネフィットの圧倒的な優位性を強調することです。スタチンによる心血管イベントの減少効果は、このわずかな血糖上昇という「コスト」をすでに支払った上での純利益です。LDLを約39 mg/dL低下させることによる血管イベント25%減少という利益は、0.7 mg/dLの血糖上昇による潜在的リスクを遥かに凌駕します。
第三に、特に高リスク層(ベースラインで血糖値が高い患者)においては、スタチン開始後の定期的な血糖モニタリングと、それに基づいた生活習慣指導を継続することです。スタチンによる血糖シフトはごくわずかであるため、それを理由にスタチンを回避したり中止したりすることは、患者を重大な心血管リスクに晒す無益な選択となります。
研究の限界と将来への展望
本研究にもいくつかの限界は存在します。まず、含まれている試験の多くが糖尿病発症を主要評価項目として設計されておらず、特に古い試験ではHbA1cの測定が体系的に行われていなかった点が挙げられます。これにより、生化学的な診断が見逃されている可能性や、逆に特定の試験での頻回な測定がリスクを過大評価させている側面があります。
また、本解析は意図治療(ITT)解析に基づいているため、長期的なアドヒアランスの低下がスタチンの真の影響を過小評価している可能性も否定できません。さらに、微小血管合併症(網膜症や腎症)に対する長期的な影響については、追跡期間の制約から本解析では十分な結論が得られていません。しかし、HbA1c 0.1%から0.2%程度の変化幅から考えれば、臨床的に重大な微小血管障害のリスク上昇を招く可能性は極めて低いと推測されます。
結論
スタチンと糖尿病の関係は、もはや漠然とした不安の対象ではありません。本研究が示したのは、数パーセントという閾値の周辺で揺れ動く代謝の動態であり、その実体は管理可能な範囲内の生理的変化です。私たちはスタチンという強力な武器を手放すことなく、その特性を正しく理解し、患者一人ひとりの代謝プロファイルに応じたきめ細やかな管理を行う知性を求められています。コレステロール低下という王道を進む中で、このわずかな血糖の揺らぎを正しく位置づけることこそが、真の意味での個別化医療への第一歩となるのです。
参考文献
Cholesterol Treatment Trialists’ (CTT) Collaboration. Effects of statin therapy on diagnoses of new-onset diabetes and worsening glycaemia in large-scale randomised blinded statin trials: an individual participant data meta-analysis. Lancet Diabetes Endocrinol. 2024;12(5):306-319. doi:10.1016/S2213-8587(24)00040-8.