はじめに
2型糖尿病は、インスリン抵抗性を背景とした膵β細胞からのインスリン分泌の進行性低下を特徴とする代謝疾患です。2025年JAMA誌に発表されたKalyaniらの総説によれば、世界で5億8900万から8億2800万人が2型糖尿病を患っており、全糖尿病症例の90-95%を占めています。アメリカでは成人の約6人に1人、15.8%が2型糖尿病に罹患している状況です。本稿では、この包括的なレビュー論文を基に、2型糖尿病の診断、管理、最新治療戦略について解説します。
疫学とリスクファクター
2型糖尿病のリスクファクターとして、高齢、家族歴、過体重/肥満、身体的不活動、妊娠糖尿病、ヒスパニック系民族、アメリカ先住民/アラスカ先住民、アジア系、黒人種などが挙げられます。興味深いことに、2型糖尿病患者の約10%は過体重や肥満を有していません。遺伝的素因としては、600以上の遺伝子多型が2型糖尿病リスクとの関連が報告されていますが、BMIの影響は遺伝的リスクスコアよりも強いことが示されています。
分子生物学的には、インスリン抵抗性は診断の10年以上前から存在している可能性があり、β細胞機能の進行性低下が高血糖の臨床的発現につながります。この「沈黙の期間」が早期発見・介入の重要性を物語っています。
診断基準と鑑別診断
2型糖尿病の診断は以下の基準で行われます:
- 空腹時血糖値 ≥126 mg/dL
- ヘモグロビンA1c(HbA1c)≥6.5%
- 75g経口ブドウ糖負荷試験で2時間値 ≥200 mg/dL
- 高血糖の典型的症状や高血糖緊急症時の随時血糖値 ≥200 mg/dL
診断には、同じ検査を2回行うか、異なる検査で2回基準値を超えることが必要です。HbA1cは赤血球寿命(2-3ヶ月)における平均血糖値を反映しますが、特定のヘモグロビン異常症、妊娠、HIV、最近の輸血、鉄欠乏性貧血、血液透析、溶血性貧血などの状況では正確性に欠けるため、血糖値基準での診断が推奨されます。
成人発症1型糖尿病や単遺伝子性糖尿病(MODY)など、他の糖尿病タイプとの鑑別が重要です。BMI<25、年齢<35歳、自己免疫の個人/家族歴がある場合には、グルタミン酸脱炭酸酵素(GAD)抗体などの膵島自己抗体検査が推奨されます。
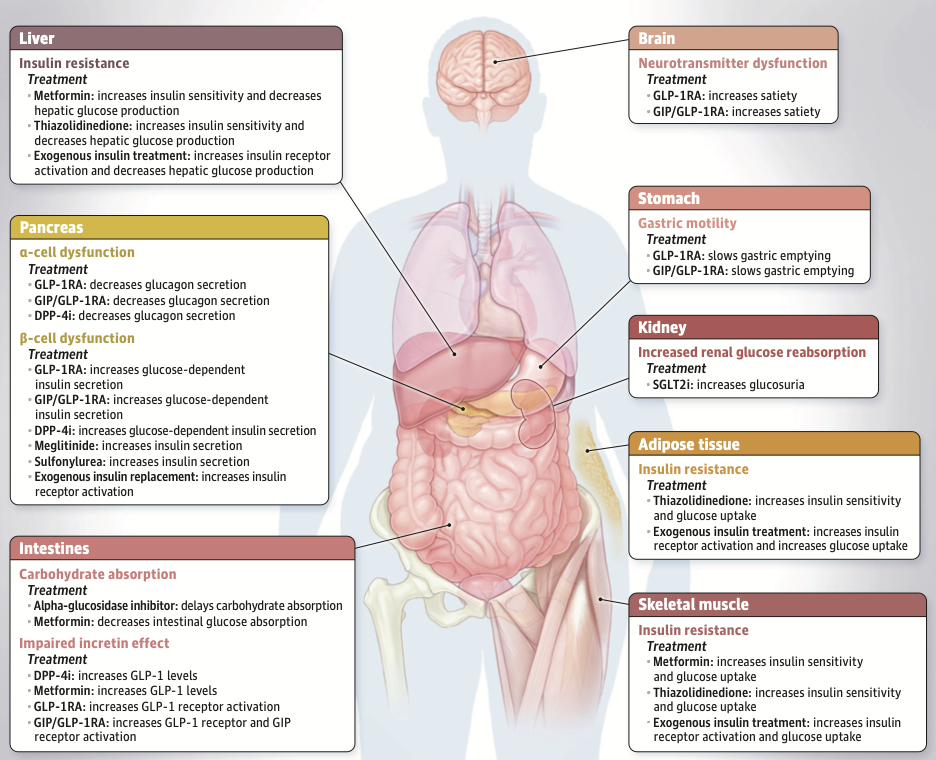
病態生理と標的臓器
2型糖尿病では、複数の臓器における病理学的異常が高血糖の発症に関与しています。
- 肝臓:インスリン抵抗性と肝糖産生の増加
- 膵臓:α細胞機能障害(グルカゴン分泌増加)とβ細胞機能障害(インスリン分泌低下)
- 脳:神経伝達物質の機能障害(満腹感の調節異常)
- 胃:胃排出能の亢進
- 腎臓:グルコース再吸収の増加
- 脂肪組織:インスリン抵抗性
- 腸管:炭水化物吸収の増加とインクレチン効果の障害
- 骨格筋:インスリン抵抗性
これらの多臓器に作用するため、治療薬もそれぞれの標的臓器に特異的に作用するように設計されています。
生活習慣介入の重要性
食事療法
特定の食事法がHbA1c改善や健康転帰に対して最も効果的であるという証拠は限定的ですが、メタ分析では以下の食事法が有意なHbA1c低下をもたらすことが示されています。
- 地中海食 vs 対照食:HbA1c差 -0.39%(95% CI, -0.58% to -0.20%)
- DASH食 vs 対照食:HbA1c差 -0.53%(95% CI, -0.62% to -0.43%)
- 低炭水化物食 vs 高炭水化物食(6ヶ月時点):HbA1c差 -0.36%(95% CI, -0.62% to -0.09%)
PREDIMED試験では、心血管リスクの高い参加者(50%が糖尿病患者)において、地中海食にエクストラバージンオリーブオイルまたはナッツを追加した群では、対照群に比べて5年間の心血管一次エンドポイント(心筋梗塞、脳卒中、心血管死)の絶対リスクが3.8%低下しました。
運動療法
126の無作為化比較試験(6,718名)のメタ分析によると、2型糖尿病患者にとって最適な運動量は1,100メッツ・分/週(中強度の有酸素運動に換算して約244分/週)で、このレベルの運動によりHbA1cが0.4%から1.0%低下します。有酸素運動と抵抗運動の両方が推奨されます。
体重管理
DIRECT試験では、非常に低カロリーのフォーミュラ食(825-853 kcal/日)と段階的な食事再導入により、介入群の46%が12ヶ月時点で糖尿病の寛解(HbA1c<6.5%かつ糖尿病薬なしで少なくとも2ヶ月間)を達成しました。Look AHEAD試験では、行動変容を基にした長期の減量介入により、持続的な体重減少、HbA1c低下、腎疾患の進行遅延、生活の質の改善などが認められました。
薬物治療の最新戦略
血糖降下薬の選択
2型糖尿病の薬物治療は、患者の個別特性や合併症に応じて選択されます。メトホルミンは依然として第一選択薬として推奨されていますが、心血管疾患(ASCVD)や慢性腎臓病(CKD)、心不全(HF)を有する患者では、SGLT2阻害薬やGLP-1受容体作動薬が早期に考慮されます。
GRADE試験では、メトホルミンに追加する薬剤として、インスリングラルギンまたはリラグルチド(GLP-1受容体作動薬)を追加した群が、グリメピリド(スルホニル尿素)またはシタグリプチン(DPP-4阻害薬)を追加した群に比べて、HbA1c>7%の発生率が低かったことが報告されています。
臓器保護を考慮した治療
心血管疾患:SGLT2阻害薬やGLP-1受容体作動薬は心血管イベントのリスクを12-26%減少させます。メタ分析では、SGLT2阻害薬は3点主要心血管イベント(心筋梗塞、脳卒中、心血管死)のハザード比を0.90(95% CI, 0.85-0.95)に減少させました。
心不全:ダパグリフロジンやエンパグリフロジンは、左室駆出率が低下した心不全(HFrEF)でも保存された心不全(HFpEF)でも、プラセボと比較して心血管死を減少させ、心不全を改善することが示されています。セマグルチドやチルゼパチド(dual GIP/GLP-1受容体作動薬)も、肥満関連HFpEF患者の症状と機能を改善します。
慢性腎臓病:SGLT2阻害薬は、腎不全への進行、eGFRの低下、腎原因による死亡を減少させます。注射用セマグルチド(GLP-1受容体作動薬)も主要腎疾患イベントを減少させることが示されました。
インスリン療法
2型糖尿病患者の約3分の1は、生涯のうちにインスリン治療を必要とします。持効型インスリンが最初に処方されることが多く、必要に応じて食前インスリンが追加されます。319名を対象とした無作為化試験では、CGMと連動した自動インスリンポンプ療法は、従来の多回数インスリン注射とCGMのみの治療に比べて、HbA1cを0.6%(95% CI, -0.8% to -0.4%)減少させました。
血糖目標とアウトカム:HbA1cの適正設定とは
血糖管理目標は、通常HbA1c <7.0%が推奨されています。UKPDSやADVANCEなどの臨床試験では、この閾値を目指すことで、網膜症や腎症といった微小血管合併症の発症リスクが有意に減少しました(例えばUKPDSでは、網膜症リスクが21%、腎疾患死が33%減少)。
ただし、ACCORD試験ではHbA1c <6.0%を目指す群で逆に死亡率が上昇(5% vs 4%、HR 1.22)したことがあり、高齢者やフレイルな患者では柔軟な目標設定が必要です。特に高齢者では、重度低血糖が転倒・骨折・認知機能悪化を招く可能性があります。
合併症管理:心血管・腎疾患にどう立ち向かうか
2型糖尿病患者の約32.2%が心血管疾患を有し、腎不全の39.2%、視覚障害の10.1%が糖尿病関連です。
SGLT2阻害薬やGLP-1受容体作動薬は、心腎保護作用を持ち、血糖値とは独立したメカニズムでも効果を発揮します。例えば、EMPA-REG OUTCOMEやCANVAS試験では、心血管死と心不全入院の両方が有意に減少しました。
薬剤選択においては、DPP-4阻害薬は心血管リスク低下の効果は乏しく、安全性の証明にとどまっています。ピオグリタゾンやメトホルミンは長期観察で一定の心血管メリットが報告されています。
個別化治療と実践的アドバイス
2型糖尿病の管理では、以下の点を考慮する必要があります。
- 血糖モニタリング:HbA1cに加え、持続血糖モニタリング(CGM)はBGMに比べてHbA1cを0.31%(95% CI, -0.43% to -0.19%)減少させます。インスリン治療中の患者では、低血糖時間を1日0.47時間減少させます。
- 治療強化のタイミング:複数の経口血糖降下薬を最大耐用量で使用しても血糖目標に達しない場合、GLP-1受容体作動薬やdual GIP/GLP-1受容体作動薬がインスリンに先立って考慮されます。
- 高齢者ケア:認知機能や身体機能が低下した高齢者では、厳格な血糖コントロールの利益が少なく、過剰治療による有害事象(特に重度の低血糖)のリスクが高まります。
- 費用対効果:SGLT2阻害薬やGLP-1受容体作動薬は高価ですが、心血管や腎臓へのベネフィットを考慮すると、特定の患者では費用対効果が高いとされています。
明日から実践できる具体的な行動
- リスク評価:40歳以上の成人やリスクファクターを有する人には定期的なスクリーニングを推奨します。
- 生活習慣改善:週に150分以上の中強度有酸素運動と週2-3回のレジスタンス運動を組み合わせます。
- 個別化目標設定:患者の年齢、併存疾患、低血糖リスクに応じてHbA1c目標を調整します(一般的に<7%、高齢者や脆弱な患者では<7.5-8.5%)。
- 合併症に応じた薬剤選択:ASCVD、HF、CKDを有する患者では、臓器保護効果のあるSGLT2阻害薬やGLP-1受容体作動薬を早期に考慮します。
- 多職種連携:糖尿病教育専門家や管理栄養士との連携を強化し、持続的なサポートを提供します。
結論
2型糖尿病は世界的に蔓延しており、心血管疾患、腎不全、視力障害、死亡率の増加などの予防可能な長期合併症を伴います。生活習慣改善に加え、メトホルミンが一般的に第一選択薬として推奨されますが、心血管や腎疾患を有する患者ではSGLT2阻害薬やGLP-1受容体作動薬の早期導入が重要です。個別化された治療アプローチと臓器保護を考慮した戦略が、患者の長期的な転帰を改善する鍵となります。
参考文献
Kalyani RR, Neumiller JJ, Maruthur NM, Wexler DJ. Diagnosis and Treatment of Type 2 Diabetes in Adults: A Review. JAMA. 2025;323(24):1-16. doi:10.1001/jama.2025.5956