はじめに
糖代謝は、単に膵臓のインスリン分泌や肝臓の糖産生といった臓器レベルの調節にとどまらず、中枢神経系と末梢神経系が緻密に関わるシステム全体の制御機構として理解されつつあります。
本論文は、近年の光遺伝学や化学遺伝学などの技術を駆使した研究成果を整理し、中枢神経回路と末梢神経回路の相互作用がどのように血糖値を調整するのかを包括的に解説しています。糖尿病患者の25%しか治療目標を達成できていない現状において、新しい治療戦略の可能性を示すものです。
中枢神経系による血糖制御
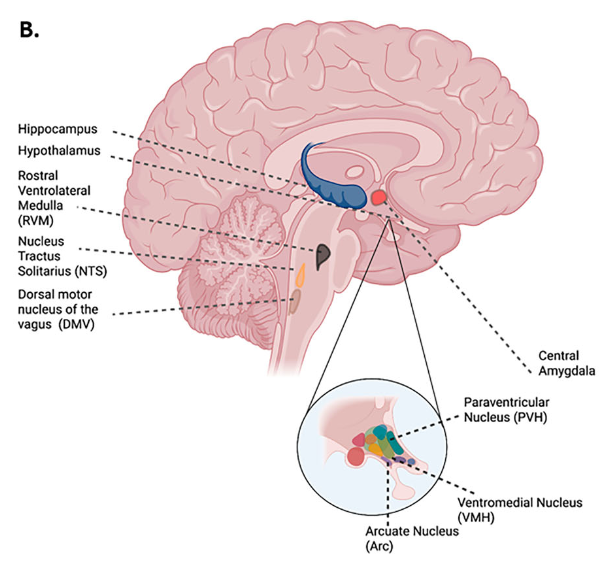
視床下部の役割
視床下部は血糖調節の中枢として最も重要な領域です。
- 弓状核(ARC)
- AgRP/NPYニューロンはインスリン抵抗性を誘導し血糖を上昇させます。
- 一方、POMCニューロンは血糖上昇に応じて活動し、インスリン感受性を改善します。
- 肥満や2型糖尿病では、このPOMCニューロンの糖感知機能が低下することが報告されています。
- 室傍核(PVH)
- オキシトシンニューロンやCRHニューロンは交感神経活性を高め、高血糖やストレス応答を引き起こします。
- AVPニューロンは低血糖時にグルカゴン分泌を誘発し、カウンターレギュレーションを担います。
- 腹内側核(VMH)
- SF-1ニューロンは双方向的に血糖を調整可能で、活性化するとインスリン感受性が改善、抑制するとグルカゴン分泌低下が生じます。
- グルコキナーゼ発現ニューロンは、絶食や低血糖時に血糖維持を担うことが示されています。
- 背内側核(DMH)
- GLP-1受容体ニューロンを介してインスリン分泌を促進し血糖を低下させる一方、NPYニューロンは高脂肪食条件下でインスリン抵抗性を助長します。
脳幹の寄与
脳幹もまた血糖制御に深く関与します。
- 孤束核(NTS):血糖上昇・低下双方に反応し、肝臓の糖産生や膵分泌を制御。
- 迷走神経背側核(DMV):副交感神経を介して肝・膵臓機能を調整。
- 延髄腹外側部(RVLM)・青斑核(LC):交感神経活性を介してストレスや低血糖時に血糖を上昇。
辺縁系の関与
- 分界条床核(BNST):ストレス応答を介して血糖上昇を誘導。
- 扁桃体(CeA):膵島と直接結合し、インスリン非依存的に血糖を制御。
- 海馬:睡眠時の神経活動と血糖変動の関連が指摘され、摂食行動との連動も示唆されています。
性差とホルモンの影響
エストロゲンは閉経前女性でインスリン感受性を高め、POMCやAgRPニューロン活性に影響します。閉経後は感受性が低下し糖尿病リスクが増加。男性ではテストステロン低下が糖代謝悪化と関連します。動物実験では雌雄で神経活動や神経ペプチド発現の反応性が異なることが明らかになっており、性差を考慮した治療戦略が求められます。
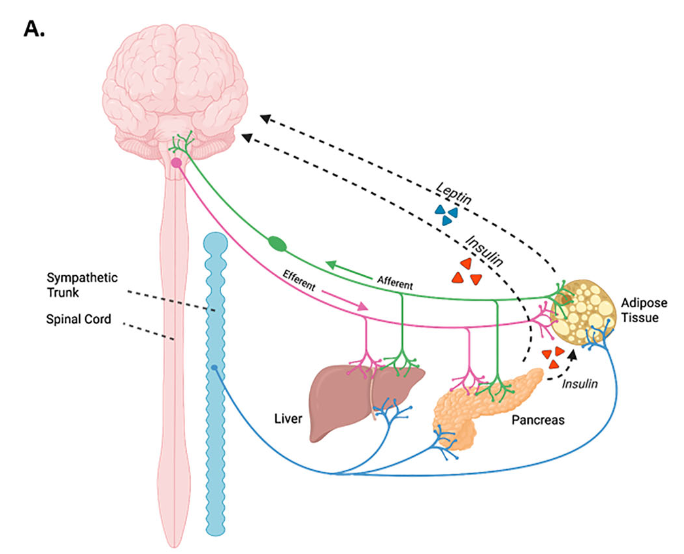
末梢神経系による血糖制御
交感神経系
- 肝臓で糖新生・グリコーゲン分解を促進。
- 膵島ではグルカゴン分泌促進・インスリン抑制。
- 脂肪組織では脂肪分解や褐色化を誘導し、代謝柔軟性を高める。
副交感神経系
- 膵島への刺激はインスリン分泌を増加させ、血糖を低下させる。
- 肝臓では糖代謝を調節するが、その詳細な作用機序にはまだ議論が残る。
感覚神経・腸管神経系(ENS)
- 膵臓や肝臓からの感覚入力は血糖制御に重要で、TRPV1線維やFGF3発現線維がインスリン分泌に影響。
- ENSは腸内細菌との相互作用を介して血糖調節に関与。GLP-1やガラニンを介し肝・筋肉での糖取り込みを改善。
病態との関連
肥満
過栄養は視床下部の炎症を誘発し、AgRPニューロンでのインスリン応答を阻害します。MRI研究でも肥満患者で視床下部炎症を示唆する信号が確認されています。
加齢
加齢によりPOMCニューロン活性が低下し、NPY発現も減少。結果として耐糖能が低下し、高齢者の糖代謝悪化に寄与します。
薬物療法の進展
GLP-1受容体作動薬
中枢神経系への作用により摂食抑制・血糖低下をもたらす。非ペプチド型の経口薬も開発中。副作用として消化器症状(悪心・嘔吐)が多く、非反応例も10〜15%存在。
SGLT2阻害薬
腎臓での再吸収抑制に加え、中枢(視床下部・扁桃体)で交感神経抑制を介して血糖と血圧を低下させる。
新規薬剤
GIP/GLP-1二重作動薬、アミリン類似体との併用、さらには神経ペプチド受容体作動薬など、CNS回路を標的とした新しい薬剤が開発中。
バイオエレクトロニクス治療の可能性
中枢刺激
- 深部脳刺激(DBS)
動物モデルや限られた臨床試験において、視床下部や側坐核(NAc)を標的とするDBSが血糖制御や体重減少に寄与することが報告されています。特に視床下部刺激は摂食行動やエネルギーバランス調節に直結しており、NAc刺激は報酬関連経路を介して食欲抑制を誘導すると考えられています。論文中では「血糖調整と体重減少が得られた」と整理されていますが、いまだ研究は初期段階であり、小規模かつ短期間の結果が中心です 。 - 経頭蓋磁気刺激(TMS)
糖尿病モデルラットにおいて耐糖能の改善が観察され、さらにヒトにおける小規模試験でもインスリン感受性改善の可能性が示唆されています。特に前頭前皮質への刺激が報酬系や食行動に影響し、間接的に血糖コントロールを改善するという仮説が提示されています 。
末梢刺激
- 超音波刺激(pFUS, peripheral Focused Ultrasound Stimulation)
肝門部に対する低強度超音波照射でインスリン感受性改善が得られたと報告されています。肝門部には、迷走神経・交感神経が豊富に分布する肝門神経叢(hepatoportal plexus)があり、血中のグルコースや代謝状態を感知する重要なハブとなっています。
動物実験に続き、初期の臨床試験でも良好な忍容性と安全性が確認されており、非侵襲的な代替療法として注目されています 。
- 迷走神経刺激(VNS)
経皮的VNSによって、糖尿病患者で血糖変動が減少し、HbA1c低下も報告されています。迷走神経は肝臓や膵臓への求心・遠心性シグナルを介し、インスリン分泌やグルコース代謝に影響するため、比較的直接的に代謝改善を誘導すると考えられます 。
将来展望
光遺伝学による膵島神経刺激でインスリン分泌とβ細胞増殖を誘導した動物実験があり、将来的な応用が期待される。新素材・無線型埋め込み装置の開発により、より精密な神経調整が可能になると考えられる。
Limitation
- 多くの知見は動物モデルに依存しており、ヒトでの長期的有効性や安全性は不明。
- 性差・加齢の影響については不十分であり、今後の研究が求められる。
- バイオエレクトロニクス治療は侵襲性や適用範囲に制約がある。
おわりに
本論文は、中枢から末梢まで広がる神経回路ネットワークが糖代謝制御の中心にあることを明確に示しました。
薬物療法とバイオエレクトロニクス治療の双方で「神経回路を標的にした新しい糖尿病治療」が現実味を帯びつつあります。将来的には、患者の性差や加齢、肥満の影響を考慮した個別化治療が可能になると考えられます。
参考文献
Han W, Park S, Kim J. Central and peripheral neural circuits regulating glucose homeostasis. npj Biomedical Innovations. 2025;3:36. doi:10.1038/s44385-025-00036-8