はじめに
長年、スタチン製剤は心血管疾患予防の要として君臨してきましたが、同時に「副作用が多い薬」という汚名も着せられてきました。製品ラベルには、筋肉症状や糖尿病リスクのみならず、記憶障害、うつ、睡眠障害、勃起不全といった多岐にわたる項目が「望ましくない影響」として列挙されています。しかし、これらの記載の多くは、バイアスの混入を避けられない観察研究や、因果関係が不明確な症例報告に基づいています。
今回、Cholesterol Treatment Trialists’ (CTT) Collaboration※が発表した大規模なメタ解析は、これまでの安全性のパラダイムを根本から覆すものです。彼らは、プラセボ対照の二重盲検ランダム化比較試験(RCT)から得られた、15万人を超える個別参加者データ(IPD)を分析することで、スタチンと副作用の真の因果関係を浮き彫りにしました。
※ CTT Collaborationは、オックスフォード大学を拠点とする「IPDメタ解析(Individual Participant Data Meta-analysis:個別患者データメタ解析)の世界的権威」であり、そのCOI管理は現時点で望みうる最高レベルの厳格さを備えています。彼らのデータは、企業のプロモーションではなく、純粋な統計学的な真実に近いものとして評価されています。
研究デザイン:PICOによる整理
本研究は、スタチンの添付文書に記載されている副作用項目の信憑性を検証するため、以下のプロトコールに基づいて実施されました。
P(対象):23の大規模二重盲検ランダム化比較試験に参加した154,664名の参加者。
I(介入):スタチン療法の割り当て(プラセボ対照試験19件、および高強度vs低強度のスタチン比較試験4件)。
C(比較):プラセボ、またはより低強度のスタチン療法。
O(アウトカム):スタチンの要約製品特性(Summary of Product Characteristics;SmPC)にリストされている副作用項目のうち、既報の筋肉症状と糖尿病を除く66項目。
試験の適格条件として、参加者1,000名以上、追跡期間2年以上、かつ二重盲検デザインであることが厳格に求められました。これにより、患者や医師の主観、あるいはメディアの情報による「ノセボ効果」を極限まで排除した、純粋な薬剤の影響のみを抽出することが可能となりました。
参考:筋症状と糖尿病(既報)
筋肉症状に関する解析結果(2022年既報)
2022年に発表された解析では、15万人以上のデータを分析し、スタチンによる筋肉症状の真実が明らかになりました。
まず、スタチンは確かに筋肉症状を引き起こしますが、その頻度は一般に信じられているよりもはるかに低いことが示されました。スタチン療法によって引き起こされる筋肉痛や衰弱の絶対的な過剰リスクは、治療1年目において約1%(1,000人あたり10人)程度です。
さらに、スタチン服用中に報告される筋肉症状の90%以上は、実はスタチンが原因ではない(プラセボ群でも同様に発生している)という衝撃的な事実も判明しました。また、重篤な筋障害である横紋筋融解症の発生は極めて稀であり、10,000人年に1件程度の頻度であることも再確認されています。
糖尿病の新規発症に関する解析結果(2024年既報)
2024年に発表された解析では、スタチンによる血糖値への影響と糖尿病発症リスクが詳細に検討されました。
結果として、スタチン療法は新規糖尿病診断のリスクを中等度、かつ用量依存的に増加させることが確認されました。低強度から中強度のスタチンでは約10%のリスク増、高強度スタチンでは約36%のリスク増が認められています。
しかし、その本質はスタチンが新規に糖尿病を引き起こすのではなく、既存の血糖値をわずかに上方にシフトさせているに過ぎないという点です。非糖尿病患者において、スタチン投与による平均血糖値の上昇は、低・中強度、高強度のいずれにおいても約0.7 mg/dL(0.04 mmol/L)程度でした。また、HbA1cの上昇幅は低・中強度で0.06%、高強度で0.08%という、極めて微小な変化にとどまっています。
重要なのは「誰が糖尿病になるのか」という点です。スタチンによって新たに糖尿病と診断された人々の多くは、服用開始前の時点で、すでに血糖値やHbA1cが診断閾値に近い「糖尿病予備軍」の状態にありました。スタチンが健康な人を突然糖尿病にするというよりは、もともとリスクが高かった人の発症時期をわずかに早めるという側面が強いことが示唆されています。
統計的厳密性の追求:FDR制御と個人レベルデータの力
本研究の最大の武器は、15万人分の生データを直接統合した「個別参加者メタ解析」である点、そして膨大な項目を検討する際に不可欠な「偽発見率(false discovery rate;FDR)制御」を導入した点にあります。
多数のアウトカムを検定すると、偶然によって有意差が出てしまう偽陽性のリスクが高まります。研究チームは、MehrotraとAdewaleによるダブルFDR手法を用い、5%の有意水準を厳格に維持しました。これにより、統計学的に「真に」差がある項目のみを峻別することに成功しました。
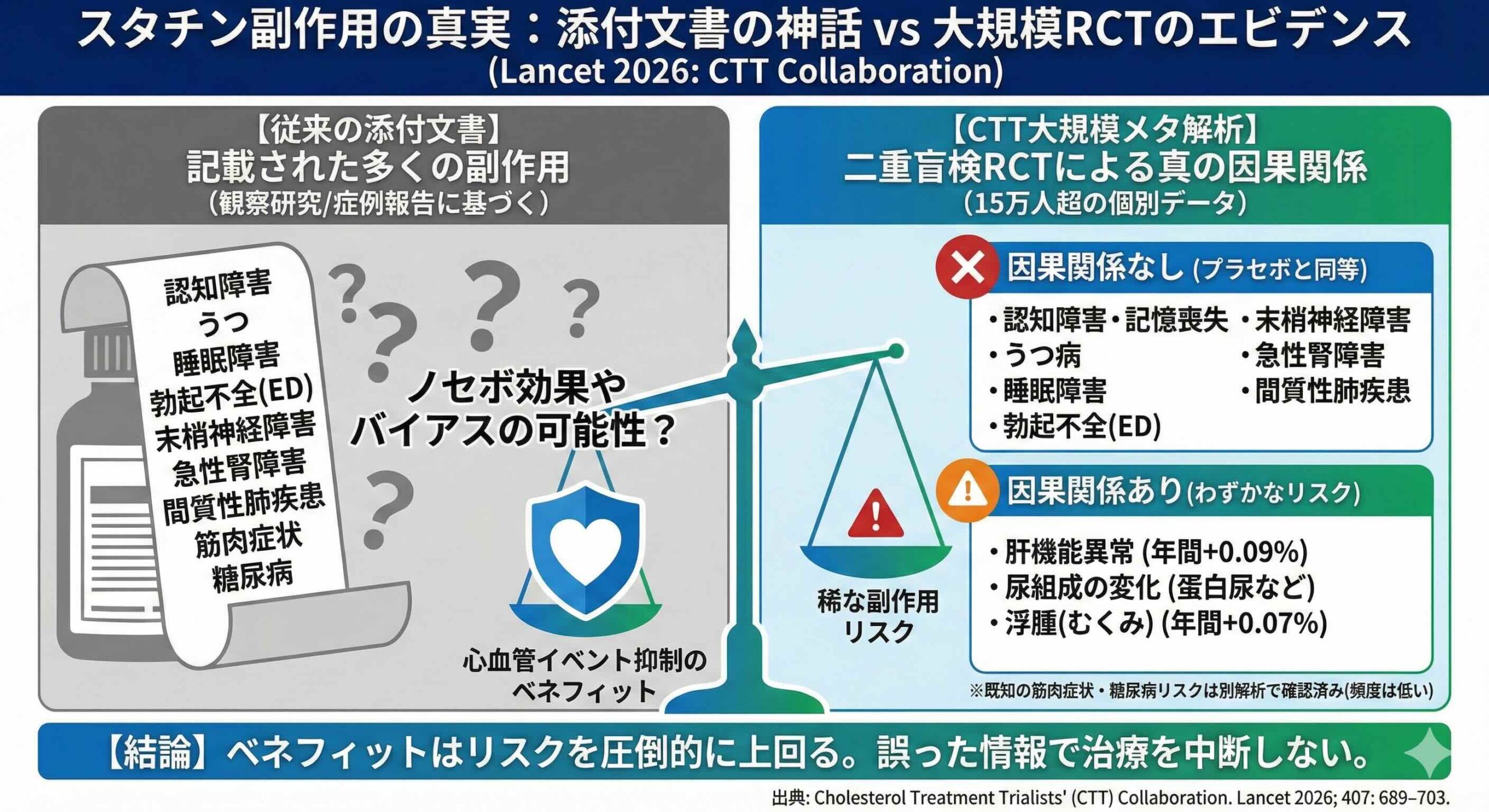
解析の結果、スタチン群とプラセボ群の間で検討された66項目のうち、統計的に有意な差が認められたのは、わずか4項目に留まりました。残りの62項目、すなわち私たちがこれまで警戒してきた多くの症状には、スタチンとの因果関係を支持するデータが得られなかったのです。
否定された「副作用」のリスト:認知、精神、そして神経
最も特筆すべき発見は、多くの臨床医が懸念し、患者が服用をためらう原因となっていた複数の項目に、有意なリスク増が認められなかったことです。具体的には、以下の項目でスタチンとプラセボの間に差はありませんでした。
・認知機能障害および記憶障害
・認知症(アルツハイマー型を含む)
・うつ病
・睡眠障害
・勃起不全および性機能障害
・末梢神経障害
・急性腎障害
・間質性肺疾患
これらの項目は、観察研究ではしばしばスタチンとの関連が指摘されてきましたが、二重盲検下ではその関連性が消失しました。これは、スタチンを服用しているという認識自体が症状を引き起こしたり、加齢に伴う自然な症状が薬剤のせいにされたりしていた可能性を強く示唆しています。
肝機能異常
一方で、本研究はスタチンによる肝機能数値の変化については、明確な因果関係を裏付けました。有意差が確認された4項目のうち、2つは肝機能検査値に関するものです。
肝トランスアミナーゼ異常については、スタチン群で年間0.30%の発現率に対し、プラセボ群では0.22%でした(Rate Ratio [RR] 1.41、95% CI 1.26-1.57)。
また、アルカリホスファターゼやガンマGTPを含むその他の肝機能異常も、スタチン群で有意に多く認められました(RR 1.26、95% CI 1.12-1.41)。これらを合わせた絶対的な年間過剰リスクは0.13%と非常に小さいものですが、統計的には極めて強固です。
さらに、強度比較試験の解析では、高強度スタチン群が低強度群に対して肝トランスアミナーゼ異常のリスクを2.06倍に高めることが示されました。特にアトルバスタチン80mg投与時において、その傾向は顕著でした。
分子生物学的な視点からは、スタチンによるHMG-CoA還元酵素の阻害が肝細胞内のコレステロール恒常性に変化をもたらし、それが一過性の酵素漏出を招く可能性が考えられます。しかし、注目すべきは、胆汁鬱滞、黄疸、肝不全、肝炎といった「臨床的に深刻な肝疾患」の指標については、スタチン群での増加が一切認められなかったことです。つまり、数値の上昇はあっても、それが実質的な臓器障害に直結している証拠は見つかりませんでした。
尿組成と浮腫
肝機能以外で有意差が認められたのは、尿組成の変化(RR 1.18)と浮腫(RR 1.07)の2項目です。
尿組成の変化について詳細に解析したところ、主に蛋白尿、アルブミン尿、あるいは微量アルブミン尿の増加が寄与していることが判明しました。スタチン服用群における尿組成変化の発生率は、年間で0.21%、プラセボ群では年間0.18%であり、スタチンによる絶対的な年間過剰リスクはわずか0.03%と算出されています 。
スタチンによる尿蛋白の増加については、これまで一部の試験で報告されてきましたが、本メタ解析はその実態を確定させました。ただし、急性腎障害や慢性腎臓病の進行リスクそのものを高めるデータは得られておらず、この蛋白尿が臨床的にどのような実害を持つかは依然として不明です。
浮腫に関しても、年間0.07%という極めてわずかな絶対リスクの増加が確認されました。しかし、肝機能異常とは異なり、浮腫と尿組成の変化についてはスタチンの強度に応じた用量反応関係が認められませんでした。この点は、因果関係の解釈に慎重さを求める結果となっています。
本研究の新規性とパラダイムシフト
本研究の新規性は、単に「副作用がないことを示した」ことではなく、「添付文書という公的な情報源の妥当性を、最高レベルのエビデンスで包括的に再検証した」ことにあります。
これまでのメタ解析は、特定の副作用(例えば筋肉痛のみ、あるいは糖尿病のみ)に焦点を当てたものが主流でした。しかし本研究は、SmPCに記載された膨大な「望ましくない影響」のリスト全体を網羅的にスキャンし、科学的根拠に基づいた仕分けを行いました。その結果、ラベルに記載されている項目の9割以上が、二重盲検RCTのデータからは裏付けられないという、衝撃的な事実を提示しました。
これは、薬剤安全性の評価において、非盲検下の報告や観察研究がいかにノセボ効果やバイアスに脆弱であるかを改めて突きつけるものです。
研究の限界:未だ残された問い
いかに大規模なメタ解析であっても、いくつかの限界が存在します。
第一に、追跡期間の制限です。本研究の追跡期間中央値は4.7年から5.0年であり、数十年単位での服用が想定される若年者や一次予防の対象者において、超長期的な影響(例えば非常に遅発性の神経変性など)を完全に否定できるものではありません。
第二に、有害事象報告の質のばらつきです。23の異なる試験からデータを収集しているため、副作用の定義や報告の閾値が試験ごとに異なる可能性があります。これを補正するためにMedDRAによる標準化が行われましたが、もともとの報告漏れを完全にカバーすることは不可能です。
第三に、生化学的データの直接的な解析ではなく、あくまで「有害事象」として報告された事象に基づいている点です。肝機能異常などは、生化学データそのものを精査すれば、より微細な変化を捉えられた可能性があります。
実践への統合:明日からの診療とアドヒアランスへの活用
この論文から得られる知見は、明日からの臨床実践、あるいは健康管理において即座に活用できる強力な武器となります。
まず、患者から「スタチンを飲むと物忘れがひどくなる」「気分が落ち込む」といった相談を受けた際、エビデンスに基づいた安心を提供することができます。「15万人を対象とした最新の研究では、そのような症状と薬の間に直接の関係はないことが証明されています。加齢やストレスなど、他の原因を一緒に探してみましょう」と、論理的に説明することが可能です。
また、不必要な服用中断を防ぐため、ノセボ効果の存在を事前に共有することも重要です。「薬の副作用だと思い込むことで、実際に体調が悪くなる現象があることがわかっています。もし何か気になることがあれば、すぐに相談してください」と伝えることで、患者との信頼関係を強化し、アドヒアランスの向上に繋げられます。
さらに、肝機能検査値の軽度上昇については、「数値は少し上がるかもしれませんが、それは深刻な肝障害を意味するものではありません」と予見的に説明しておくことで、検査結果による患者の過度な不安を取り除くことができます。
本研究は、スタチンの真の姿を浮き彫りにしました。微小な生化学的変化というコストを払いつつも、心血管疾患の予防という巨大な利益を享受できるという事実は、依然として揺るぎません。科学に基づいた正確な情報の提供こそが、過度な副作用への恐怖を打ち消し、真に命を守る治療へと患者を導く唯一の道なのです。
参考文献
Cholesterol Treatment Trialists’ (CTT) Collaboration. Assessment of adverse effects attributed to statin therapy in product labels: a meta-analysis of double-blind randomised controlled trials. Lancet 2026; 407: 689–703.