序論:エストロゲンの「二面性」をめぐる再考
長らくエストロゲンは「心血管保護ホルモン」として知られてきました。女性における閉経後の心血管リスク上昇は、エストロゲン欠乏が原因の一つとされ、ホルモン補充療法(HRT)はその予防策と考えられてきました。しかし近年、経口避妊薬やHRT、あるいはトランスジェンダー女性に対する長期エストロゲン投与において、むしろ心血管イベントのリスク増加が報告されるようになり、この「保護ホルモン」説に揺らぎが生じています。
本研究の目的は、その矛盾を分子レベルで解き明かすことにあります。著者らは、エストロゲンが単に善玉でも悪玉でもなく、時間依存的・性依存的に異なる作用を発揮するのではないかと考えました。その鍵となるのが、細胞膜の脂質成分であり、細胞死やシグナル伝達に深く関与するスフィンゴ脂質(sphingolipids)です。
こちらも参考に。
研究の背景と仮説:スフィンゴ脂質経路という「分子スイッチ」
スフィンゴ脂質は、細胞膜の構成要素であると同時に、シグナル伝達分子としても重要です。スフィンゴ脂質の代謝経路には、「セラミド(ceramide)」と「スフィンゴシン-1-リン酸(S1P;
sphingosine-1-phosphate)」という二つの主要な分子が存在します。セラミドは細胞老化やアポトーシスを促す“ブレーキ”分子であり、一方のS1Pは血管拡張や細胞生存を促す“アクセル”分子です。このバランス、ceramide:S1P比(スフィンゴ脂質レオスタット※を構成する主要な要素)は、細胞の生死や炎症、血管の反応性を決定づけると考えられています。
セラミドはアポトーシスや酸化ストレスを促し、S1Pは血管拡張や生存シグナルを誘導します。つまり、セラミド:S1P比の上昇は内皮障害の兆候といえます。
著者らは、エストロゲンがこのレオスタットを性差特異的に制御するのではないかと仮定しました。すなわち、急性のエストロゲン刺激ではNO(Nitric Oxide)を介した血管拡張を誘導する一方、慢性的なエストロゲン曝露はセラミドの蓄積を引き起こし、酸化ストレスを通じて内皮障害を招くという仮説です。
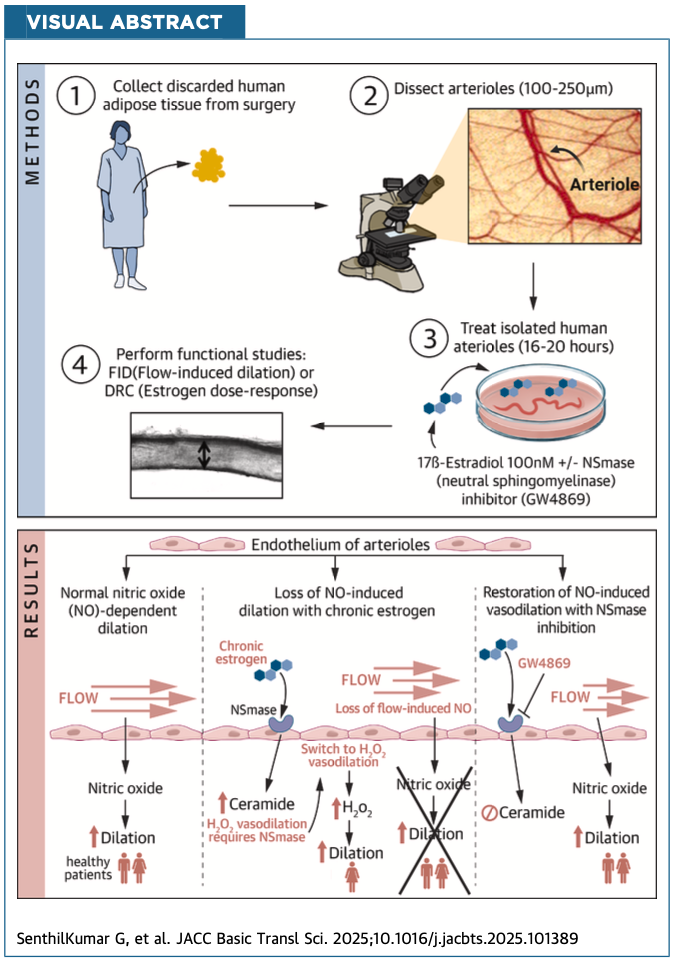
その根拠は、以前の研究で、ヒト小動脈を17β-エストラジオール(E2)に長時間曝露させると、流れ刺激による拡張(flow-induced dilation: FID)が一酸化窒素(NO)依存から過酸化水素(H₂O₂)依存へと転換し、酸化ストレスを介した内皮機能障害が生じることが確認されていたためです。
※スフィンゴ脂質レオスタット(sphingolipid rheostat)とは、スフィンゴ脂質代謝経路における複数の代謝物(主にセラミド、スフィンゴシン、スフィンゴシン-1-リン酸)が形成する動的バランスを指し、この比率が細胞の「生存」あるいは「アポトーシス」を制御する、という概念です。
方法:ヒト微小血管を用いた厳密な実験設計
研究では、健常成人43名(男性9名、女性34名)から外科手術時に得られた脂肪組織内小動脈を用い、加圧マイオグラフィーによって血管拡張反応を評価しました。
エストラジオール(E2)は急性(10⁻¹¹~10⁻⁵ mol/L)と慢性(100 nmol/Lを16–20時間)で投与され、それぞれの反応性を比較しています。
さらに、経路特異的な阻害薬を用いて、作用機構を検証しました。主な薬剤は以下の通りです。
- 中性スフィンゴミエリナーゼ(NSmase;neutralsphingomyelinase)阻害薬:GW4869
- スフィンゴシンキナーゼ阻害薬:SpK-I
- ミトコンドリア抗酸化薬:MitoTempol
また、性別を分けたヒト臍帯静脈内皮細胞(HUVEC)を用いて、スフィンゴ脂質の定量(LC-MS/MS)と酸化ストレスの測定を行いました。
結果1:急性エストロゲン刺激は「保護的」に作用する
急性エストロゲン刺激では、女性の小動脈で顕著な濃度依存性の血管拡張が観察されました。この反応はNO合成阻害薬(L-NAME)やNSmase阻害によって完全に消失したことから、NSmase/セラミド/S1P経路を介したNO生成が関与していると示されました。
この現象は男性ではほとんど見られず、性差のあるエストロゲン受容体およびeNOS発現が一因と考えられます。すなわち、短期的なエストロゲン作用は女性で優位に内皮機能を改善する可能性があります。
結果2:慢性曝露では「逆転現象」が起こる
一方で、同じE2を16~20時間曝露した場合、女性の小動脈では血管拡張のメディエーターがNOから過酸化水素(H₂O₂)に転換しました。
これは「NO依存性からH₂O₂依存性へのシフト」と呼ばれ、慢性的な酸化ストレス状態を示します。実際、拡張反応そのものも低下し、典型的な内皮障害パターンを呈しました。
この変化はNSmase阻害薬で抑制され、さらにミトコンドリア抗酸化薬MitoTempolの併用により拡張能が回復したことから、セラミド蓄積によるミトコンドリア起源の酸化ストレスが主要な病態機序であると結論づけられました。
結果3:性差を規定するスフィンゴ脂質のバランス
質量分析による脂質定量では、以下のような興味深い性差が確認されました。
- 男性細胞は基礎的にセラミドが高値でS1Pが低値。
- 女性細胞はE2曝露後に長鎖セラミドが著明に上昇し、S1P産生は抑制。
- 結果として女性ではセラミド/S1P比が上昇し、プロアポトーシス環境が形成される。
このバランス変化こそが、慢性エストロゲン曝露に伴う女性特異的な内皮障害を説明する分子基盤であると著者らは指摘しています。
考察:エストロゲン作用は「時間と性」に依存する
本研究の最大の洞察は、エストロゲンの作用が単純な「有害/有益」ではなく、暴露の時間軸と性差によって二相性に変化することを明確に示した点です。
短期的にはNOを介した血管拡張を促す一方、長期的・高濃度曝露ではセラミドが蓄積し、酸化ストレスとミトコンドリア機能障害を引き起こす。これは、経口避妊薬やHRTで報告される血栓症・虚血性心疾患リスク上昇を裏づける分子機構の一つと考えられます。
さらに、女性優位の反応性は、エストロゲン受容体発現の高さだけでなく、スフィンゴ脂質代謝経路そのものが性差により調整されていることを示唆しています。この観点から、性差を無視したホルモン療法の設計は再考が求められます。
新規性:スフィンゴ脂質代謝を介した性差依存的血管調節という新概念
これまでエストロゲン研究は主に受容体レベル(ERα/ERβ)のシグナル伝達に焦点が当てられてきました。しかし本研究は、スフィンゴ脂質代謝の性差依存的制御という新たな層を提示しました。
特に、エストロゲンがNSmaseを介してセラミド合成を誘導し、その結果、血管内皮の反応性が時間依存的に変化するという発見は、臨床的にも大きな意義を持ちます。
これは、ホルモン療法や性別適合治療における「用量・時間・性別」に基づく精密な個別化アプローチの必要性を強く示唆しています。
臨床的・実践的意義:ホルモン療法をどう使いこなすか
臨床現場での最も実践的な教訓は、「エストロゲンの持続的・過剰な曝露を避ける」ことです。
周期的変動を模倣したホルモン補充、あるいは低用量でのパルス投与が、生理的エストロゲンの短期的利点(NO依存性拡張)を維持しつつ、慢性酸化ストレスを回避できる可能性があります。
また、今後は血中または尿中のセラミド/S1P比が、エストロゲン関連血管障害の早期バイオマーカーとして応用される可能性もあります。
この比率を維持・修正する薬理学的手段(例えばNSmase阻害薬やミトコンドリア抗酸化薬)も、ホルモン療法の安全性を高める戦略になりうるでしょう。
Limitation:研究の制約
本研究はヒト由来組織を用いた点で高い生理的妥当性を持ちますが、いくつかの制約もあります。
- 検体は外科手術時に得た脂肪組織からの小動脈であり、全身血管を代表していない。
- 参加者のホルモン使用歴や月経周期の情報が限定的。
- 性転換女性など臨床的高エストロゲン曝露例を含まない。
- 使用した内皮細胞(HUVEC)は静脈由来であり、動脈内皮の反応性とは異なる可能性がある。
したがって、本結果は「ヒトにおける重要な機構の一端を示す」ものであり、臨床応用にはさらなる検証が必要です。
結語:ホルモンと脂質の対話が描く新しい血管生理
この研究は、エストロゲンが単なるホルモンではなく、脂質代謝を介して血管の運命を左右する分子指揮者であることを明らかにしました。
急性作用ではNOを奏で、慢性作用ではセラミドが不協和音を響かせる——そのメカニズムを明確に描き出した点に、この論文の真の価値があります。
明日から私たちができることは、ホルモン治療を“量”ではなく“質と時間”で設計し直すことです。
そして、血管内皮の健康を守る鍵が、性差と脂質代謝の微妙なバランスにあることを忘れてはなりません。
参考文献
SenthilKumar G, Zirgibel Z, Jaramillo-Torres MJ, et al.Estrogen Influences Human Microvascular Endothelial Function Via Sex-Specific Regulation of Sphingolipids.
JACC: Basic to Translational Science. 2025;10.1016/j.jacbts.2025.101389.
おまけ 1:臨床とのギャップ
SenthilKumarら(2025)の実験設定における「急性曝露」と「慢性曝露」は、臨床的な時間軸とは大きく異なり、in vitro/ex vivoモデルにおける“機序的時間スケールとして理解する必要があります。
以下に、論文の実験デザインと臨床的含意のギャップを整理します。
1. 研究デザイン上の時間スケール
本研究は、ヒト小動脈(arterioles)および培養内皮細胞(HUVEC)を用いた実験的研究であり、エストロゲン(E2)作用を急性(短期)と慢性(長期)の2条件で評価しています。
| 条件 | 曝露時間 | 用量 | 主な観察内容 | 結果 |
|---|---|---|---|---|
| 急性曝露 | 約30分以内 | 10⁻¹¹–10⁻⁵ mol/L E2 | 血管拡張反応、NO・H₂O₂依存性、NSmase阻害 | 健常女性の小動脈でNO依存性拡張を確認。NSmase阻害で反応低下。 |
| 慢性曝露 | 16–20時間 | 100 nmol/L E2 | 血管反応性の持続的変化、スフィンゴ脂質変動 | NO依存性拡張が失われ、H₂O₂依存性に変化(dysfunction)。 |
この「16~20時間」という設定は、急性刺激後の転写・翻訳レベルの変化(脂質代謝酵素の発現やROS生成経路の恒常化)を再現するための実験的“中間スケール”です。
臨床的な“慢性曝露”とは異なり、「1日単位での細胞内経路のスイッチング」を観察する目的です。
2. 臨床的時間軸との乖離
確かに、臨床的なエストロゲン曝露は次のようなスケールです。
- 生理的変動:月経周期に伴うE2濃度変動(数日~数週間単位)
- 妊娠・閉経・HRT:年単位での高・低エストロゲン環境の持続
- 薬理的曝露:ホルモン補充療法や避妊薬の定常投与(長期的)
これらは、代謝恒常性、受容体発現調整、エピジェネティクス変化、さらには血管リモデリングなどを伴う全身的なホルモン環境の再構築であり、
本研究の16~20時間曝露とは時間的にも階層的にも異なります。
したがって、本研究の「慢性」とは、細胞生理学的レベルでの“持続刺激”モデルであって、臨床的な長期曝露(年単位)とは直接対応しません。
この点は、解釈の際に慎重さが求められます。
3. それでもこのモデルが意味を持つ理由
短時間(数時間~1日)の「慢性曝露モデル」が臨床的意義をもつ理由は、初期シグナルの方向性(acute-to-chronic transition)を可視化できる点にあります。
すなわち:
- 急性E2曝露ではNO産生が促進 → 血管保護的
- 持続的E2曝露(16–20h)でスフィンゴ脂質経路(nSMase/ceramide/S1P)が再構成 → H₂O₂依存化・内皮機能障害
この変化は、長期的に観察されるホルモン曝露の“分子的方向性”を示すものであり、
実際のHRTや閉経後女性の血管障害リスク上昇に通じる“初期ステップ”とみなすことができます。
臨床的な年単位の変化は、この分子経路の慢性化(転写因子・酸化ストレス応答の恒常化)として進行する可能性が高いと考えられます。
4. 臨床への含意
- この実験系の「急性 vs 慢性」は、臨床スケールでいう“急性・慢性”とは異なる言葉の使い方です。
- 本研究は「エストロゲン曝露の初期反応が、時間依存的にNO経路からH₂O₂経路へと変化する」ことを示唆。
- この現象は、長期的HRTや高エストロゲン環境における血管酸化ストレス増大の分子基盤を説明しうる。
- ただし、年単位での曝露や代謝適応、受容体発現変化、エストロゲン代謝物の影響まではこのモデルでは再現されていません。
5. まとめ
| 観点 | 急性(Acute) | 慢性(Chronic, 16–20h) | 臨床的曝露 |
|---|---|---|---|
| 時間スケール | 分~数十分 | 約1日 | 月~年 |
| 主な機構 | eNOS活性化 → NO産生 | nSMase活性化 → ceramide蓄積 → H₂O₂依存性拡張 | 代謝適応、血管リモデリング |
| 臨床的対応 | 一過性ホルモン変動(排卵期など) | 分子経路の可塑性・初期酸化ストレス反応 | HRT、閉経後動脈硬化、エストロゲン長期作用 |
| 意義 | 内皮保護的作用 | 内皮障害性転換の分子基盤 | 慢性期病態の背景仮説 |
したがって、臨床的な「HRTの長期影響」を直接評価した研究ではありませんが、
16–20時間という“中間スケール”が、血管内皮における時間依存的スイッチ(NO→H₂O₂)を明らかにした点が、本研究の価値と新規性です。
おまけ 2:2軸で整理する
この論文は、「エストロゲン作用の急性 vs 慢性の違い」と「性差(男性と女性での反応の違い)」という2つの軸でエストロゲンの血管作用を解析・議論しています。
1. 急性作用(acute estrogen effect)
著者らは、ヒト小動脈において17β-エストラジオール(E2)の急性刺激が女性では一酸化窒素(NO)依存性の血管拡張を誘導することを確認しています。一方で、男性由来の血管ではこの反応が著しく弱く、これはエストロゲン受容体およびeNOSの発現量が低いことが原因であると説明されています。
2. 慢性作用(chronic estrogen effect)
同じE2を長時間曝露(16〜20時間)させると、女性の小動脈ではNO依存性拡張が失われ、過酸化水素(H₂O₂)依存性の拡張に転換する現象がみられました。さらに一部の血管では拡張そのものが障害されました。これらの変化は中性スフィンゴミエリナーゼ(NSmase)経路を介したセラミド蓄積によって生じており、NSmase阻害薬の併用で血管機能が回復したと報告されています。
この「急性→慢性で作用が反転する」ことが、本研究の第一の軸です。
3. 性差(sex differences)
研究の第二の軸として、エストロゲン作用の性差が詳細に分析されています。
男性では急性E2反応が小さく、内皮セラミドが女性より高値かつS1Pが低値であることが確認されました。これにより、男性内皮ではもともと酸化ストレス優位な「セラミド:S1Pバランス」が存在し、エストロゲン刺激に対する感受性が低いと考えられます。
一方、女性ではE2曝露後に長鎖セラミドが上昇し、慢性曝露でH₂O₂依存性の内皮障害が顕著になります。
つまり、男性は反応しにくいが障害は起こりにくく、女性は反応しやすいが慢性曝露で障害を受けやすいという二重構造が明らかになっています。
4. まとめ:二軸モデルによるエストロゲン作用の再定義
論文全体を通じて、著者らは次の2軸を提示しています。
| 軸 | 対応する現象 | 主な分子経路 |
|---|---|---|
| 時間軸(急性→慢性) | NO依存性拡張 → セラミド蓄積 → H₂O₂依存性障害 | NSmase/セラミド/S1P経路 |
| 性差軸(男性↔女性) | 受容体・eNOS発現差/セラミド:S1Pバランス差 | エストロゲン受容体+スフィンゴ脂質代謝差 |
これにより、「エストロゲンは一様に血管保護的ではない」こと、そしてその作用が時間経過と性差によって二重に規定されることを明確に示しています。
したがって、この論文は明確に
- 急性 vs 慢性作用の違い(時間軸)、
- 性差による反応性の違い(生物学的性軸)
という2つの軸構造を中心概念として設計・解釈されています