動脈スティフネス(arterial stiffness, AS)は、血管壁の弾性喪失を特徴とする病態であり、単なる加齢現象ではなく、慢性腎疾患(CKD)や糖尿病、高血圧といった病態と密接に関係する心血管リスクの早期マーカーです。本稿では、Tsaiらによる論文「Arterial stiffness: A brief review(Tzu Chi Medical Journal 2021;33(2):115–121)」をもとに、ASの病態、診断、臨床的意義、そして治療介入を解説します。
動脈スティフネスの背景
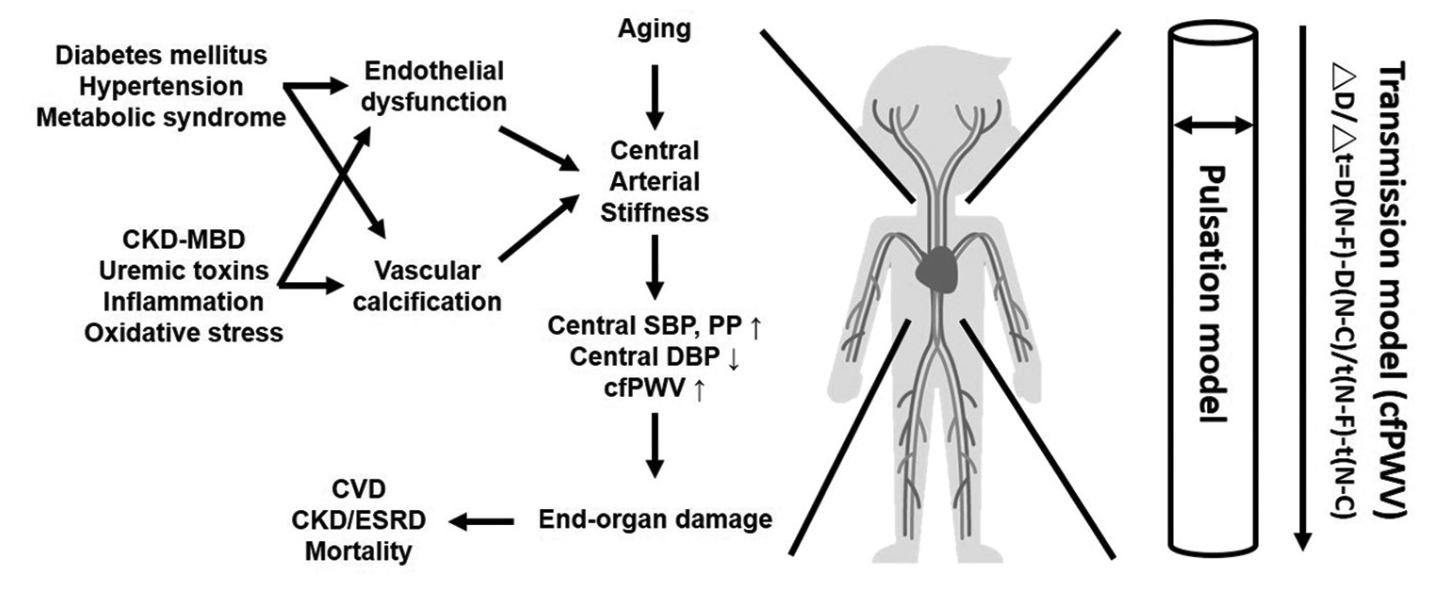
これまで、ASは主に高齢者の血管硬化現象として受け止められてきましたが、Tsaiらの論文では、慢性腎疾患における非伝統的リスクファクター(例:尿毒素、異常ミネラル代謝、血管石灰化など)がASの進行に重要な役割を果たすことを強調しています。特に注目すべきは、ASが心血管疾患だけでなく、腎機能低下そのものの予測因子となる点です。この視点は、従来のASの捉え方に対して大きな臨床的示唆を与えます。
なお、動脈スティフネス(arterial stiffness, AS)は、以前このブログでも出てきた「arteriosclerosis:動脈硬化症」とほぼ同義です。
動脈スティフネス(AS)の主な病態メカニズム
ASの本質は、血管壁を構成するエラスチン線維とコラーゲンの調節異常にあります。健康な血管ではエラスチンが血管の伸縮性を、コラーゲンが構造的強度を担っていますが、加齢やCKDではエラスチンの断片化とコラーゲンの過剰蓄積が生じます。分子レベルでは、活性酸素種(ROS)の増加と一酸化窒素(NO)の減少が内皮機能障害を引き起こし、内皮型NO合成酵素(eNOS)の発現低下をもたらします。
加齢による血管リモデリング
加齢は血管内皮の弾力性を損ない、NO(nitric oxide)生成能の低下とROS(reactive oxygen species)産生の増加をもたらします。特に、内皮依存性拡張反応の低下がAS進展の基盤とされており、老化に伴う弾性線維の断裂や中膜の石灰化も進行します。
例えば、ESRD(末期腎不全)患者では、大動脈PWV(pulse wave velocity)が顕著に上昇し、cfPWVと年齢の間に明確な相関関係が報告されています。
血管石灰化(Vascular calcification;VC)
特にCKD患者では、血管石灰化(VC)がASを増悪させます。血清リン濃度が5.5mg/dLを超えると、血管平滑筋細胞が骨芽細胞様に形質転換し、リン酸カルシウム結晶が血管中膜に沈着します。この過程はFGF23(線維芽細胞増殖因子23)の上昇とも関連しており、CKDステージ5では77%の患者にVCが認められます。
血圧上昇と波の反射
高血圧はASの原因であると同時に結果でもあります。高AS状態では、収縮期血圧(SBP)が上昇し、拡張期血圧(DBP)が低下、脈圧(PP)が拡大します。波の反射が早期に大動脈へ帰還することで、左室への負荷も増加し、左室肥大や心不全のリスクが高まります。
尿毒素と血管の分子毒性
慢性腎臓病(CKD)患者において、ASは通常の加齢過程を超えて加速し、心血管死亡率を2.14-2.35倍に上昇させることが報告されています。
CKDとASは双方向性の関係にあります。eGFRが60mL/min/1.73m²を下回るとASが顕著になり、逆にASが進行すると腎血流が減少しCKDが悪化します。この悪循環の中核をなすのが、腸管由来の尿毒症毒素(インドキシル硫酸[indoxyl sulfate(IS)]とp-クレジル硫酸[p-cresyl sulfate(PCS)])です。
これらは通常は腎臓から排泄されますが、CKDの進行とともに血中に蓄積し、有害作用を及ぼします。
これらは内皮細胞の増殖抑制、ROSの誘導、NO産生抑制、血管平滑筋細胞の増殖促進など、多面的にASを悪化させます。実際、ISの血中濃度はcfPWVおよび大動脈石灰化スコアと有意な相関を示しており、末期腎不全(End Stage Renal Disease:ESRD)患者の心血管死亡の予測因子としても注目されています。
これらの知見は、CKD患者におけるAS管理には従来の血圧コントロールだけでなく、尿毒症毒素の軽減が重要であることを示唆しています。ちなみに、タンパク結合性が高いため、透析での除去が極めて困難のようです。
メタボリック症候群と糖尿病がもたらす血管硬化
BMI、腹囲、収縮期血圧、空腹時血糖値といったメタボリック症候群の構成因子は、それぞれがcfPWVと有意な正の相関を持ちます。糖尿病では、AGEs(終末糖化産物)の産生が増加し、これはcfPWVの独立した上昇要因です。
Tsaiらの研究グループは、冠動脈疾患(CAD)を有する患者において、高AS群は低AS群に比べて糖尿病の有病率、空腹時血糖、インスリン濃度、HOMA-IRが高いことを示しています。こうした代謝背景の違いが、ASの進展速度を決定づけているのです。
AGEs(終末糖化産物)と動脈スティフネス
AGEs(終末糖化産物:advanced glycation end products)の産生が増加すると動脈スティフネス(arterial stiffness)が進行する理由は、構造的変化と機能的変化の双方が血管壁に生じるためです。
AGEsの形成と蓄積:背景
AGEsは、グルコースや他の還元糖がタンパク質、脂質、核酸と非酵素的に結合(糖化)し、長期間にわたって体内で蓄積される複雑な化合物です。特に高血糖状態や酸化ストレス状態ではAGEsの生成が加速されます。
AGEsが血管構造に与える影響:架橋と硬化
AGEsは、特にコラーゲンやエラスチンといった細胞外マトリクス成分に架橋(cross-linking)を形成します。
- コラーゲンとAGEsが結合すると、コラーゲン線維が過剰に安定化し、可塑性が失われて硬く脆くなります。
- エラスチンにも同様の影響があり、血管の伸展性(compliance)が低下します。
これにより、動脈が「硬く」なり、パルスウェーブが速く伝わる=cfPWV(carotid-femoral pulse wave velocity)が上昇します。これは動脈スティフネスの臨床的指標です。
AGEs受容体(RAGE)を介した炎症・酸化ストレスの誘導
AGEsは、血管内皮細胞や血管平滑筋細胞に発現しているRAGE(receptor for advanced glycation end products)に結合します。
この結合は、以下の炎症・酸化ストレス経路を活性化します:
- NF-κBの活性化:炎症性サイトカイン(IL-6、TNF-αなど)や接着分子(VCAM-1, ICAM-1)の転写が促進され、慢性炎症状態を形成します。
- NADPHオキシダーゼ活性化 → ROS産生増加:これによりNO(一酸化窒素)の生物学的利用能が低下し、血管の拡張反応が阻害されます。
結果として、AGEsは内皮機能障害(endothelial dysfunction)を惹起し、血管トーヌスが亢進したままとなり、スティフネスが進行します。
血管平滑筋細胞(VSMC)の表現型変化と石灰化促進
AGEsは血管平滑筋細胞(vascular smooth muscle cell, VSMC)にも作用します:
- 増殖や移動性を高め、炎症性表現型に変化させる。
- RAGEシグナルを介してアルカリフォスファターゼ活性や骨関連タンパク質(RUNX2、BMP-2など)の発現を誘導し、血管石灰化を促進します。
これもASの進行に寄与します。
cfPWVによる診断と臨床的意義
cfPWV(頸動脈-大腿動脈PWV)は、ASの「ゴールドスタンダード」として国際的にも評価されています。
- cfPWV >10 m/sがASの診断基準値とされ、
- cfPWVが5 m/s上昇するごとに、全死因および心血管死リスクが2倍以上になるとの報告があります(Laurentら)。
- 糖尿病患者では、cfPWVが1 m/s増加するごとに、死亡リスクが1.08倍となります。
このように、cfPWVは単なる血管の指標ではなく、臓器予後を示す生体マーカーとして活用される時代になっています。
ABCDE戦略:動脈スティフネスを制御する実践的アプローチ
TsaiらはASの管理に「ABCDE戦略」というフレームワークを提案しています。
A:降圧薬(Antihypertensives)
RAS阻害薬(ACE阻害薬・ARB)はcfPWVを−1.15〜−1.69 m/s低下させる可能性があります。CCBやβ遮断薬も有効ですが、血圧とは独立してASを改善する作用はRAS阻害薬の方が優れている可能性が示唆されています。血圧低下以外のpleiotropic effect(多面的作用)と言うことです。
B:体重減少(Body weight loss)
生活習慣改善による体重8%減少でcfPWVが有意に改善したというメタ解析が報告されており、脂肪組織由来の炎症性サイトカインの減少がその背景にあります。内臓脂肪の減少により、炎症性サイトカイン(TNF-αやIL-6)の産生が抑制され、血管内皮機能が改善すると考えられます。
C:コレステロール低下(Cholesterol lowering)
スタチンはLDLコレステロール低下作用に加え、抗炎症作用によりcfPWVを平均−0.68 m/s低下させます。ただし、CKD後期ではこの効果は限定的であり、早期からの介入が重要です。
D:糖尿病治療(DM treatment)
GLP-1受容体作動薬やSGLT2阻害薬は、単なる血糖コントロールに留まらず、酸化ストレス軽減や内皮機能改善を通じてASを改善することが期待されています。
E:腎疾患管理(ESRD/CKD treatment)
尿毒素除去剤(AST-120)やビタミンD補充は、cfPWVを改善する可能性があります。ビタミンD不足の患者では、cfPWVの標準化平均差 −0.29の改善が報告されています。
AS予防のために今日からできること
- 家庭血圧の記録を始めることで、AS進行のモニタリングに役立ちます。
- 腹囲・BMIの定期的な測定は、代謝リスクの早期発見につながります。
- 高リン食や加工食品の制限を心がけることで、血管石灰化を抑制できます。
- 軽い有酸素運動(ウォーキングなど)を週に3回以上行うことで、cfPWVの進行を予防できます。
- 定期的なcfPWV測定を検討し、ASの早期発見・介入を目指しましょう。
おわりに
動脈スティフネスは、単なる生理的老化現象ではなく、腎疾患や心血管疾患の可視化されたリスク指標です。cfPWVという手軽かつ信頼性の高い指標を活用し、ABCDEに基づく多面的介入を行うことで、私たちは血管の「時間」を遅らせることができます。この知見を臨床だけでなく、個々人のライフスタイルにも反映させていくことが、健康長寿への確かな一歩となるでしょう。
参考文献
Tsai JP, Hsu BG. Arterial stiffness: A brief review. Tzu Chi Medical Journal. 2021;33(2):115–121. doi:10.4103/tcmj.tcmj_44_20
追記:家庭血圧の記録により「AS(動脈スティフネス)の進行」に気づくための兆候
収縮期血圧(SBP)の上昇
ASが進行すると、大動脈や中〜大動脈の弾性が低下し、心臓が拍出する血液をうまく吸収できなくなるため、SBP(最高血圧)が上昇します。とくに早朝や起床直後の血圧上昇(モーニングサージ)は、ASの進行と関連が深いです。
脈圧(Pulse Pressure:SBP−DBP)の拡大
ASが進むと、血管が硬くなることで反射波が早期に心臓に戻り、収縮期血圧がさらに高まり、拡張期血圧(DBP)が下がる傾向があります。その結果、脈圧(PP)が拡大します。
- 若年者ではPPが40 mmHg程度なのに対し、
- 高齢者やAS進行例では60 mmHg以上に達することも珍しくありません。
この脈圧の拡大こそが、AS進行の最も分かりやすい家庭モニタリング指標の1つです。
拡張期血圧が低下するメカニズムをもう少し詳しく。
大動脈の「貯蔵タンク機能」が低下する
健康な若年者では、大動脈などの弾性動脈が血液を一時的に蓄え、心臓が休んでいる拡張期に末梢に血液を押し出す「貯蔵タンク」機能(Windkessel効果)を果たしています。
ところが、ASが進行すると:
- 大動脈の弾性が失われ、拡張期に十分に収縮できなくなる
- その結果、拡張期に押し出す血流が減り、DBPが低下します
→ このようにして「拡張期の血管内圧が保てなくなる」のがDBP低下の本質です。
反射波の早期帰還
動脈硬化により、血流が末梢から跳ね返るタイミングが早まり、反射波が拡張期ではなく収縮期に重なるようになります。
- 本来、反射波は拡張期を補強するために遅れて戻ってくる
- しかしASでは、反射波が早く戻り、収縮期BPを上げ、拡張期BPを下げる
この結果、SBP↑、DBP↓、脈圧拡大という典型的なASの血圧パターンが形成されます。
末梢血管抵抗の相対的低下
- 拡張期血圧は末梢血管の抵抗と心拍出量のバランスにより決定されます。
- ASが進むと、大動脈のコンプライアンスが低下し、中央から末梢への血流伝達が効率悪化
- 末梢側では、慢性的な急激な血流により血管調整能が低下し、相対的に抵抗が下がる
- 結果として、拡張期の平均血圧が低くなりやすい状態になります。
拡張期灌流の低下=臓器リスク
拡張期は冠動脈への血流供給の時間帯でもあります。DBPが低くなると:
- 冠血流が減少し、心筋虚血のリスクが上昇
- 脳、腎臓などの灌流圧が低下しやすくなり、虚血性イベントのリスクが増大
このため、DBPが70 mmHg未満(特に60 mmHg未満)になると、逆に心血管イベントリスクが増えるというU字型のリスクカーブが報告されています(J-curve phenomenon)。
要点まとめ
| 原因 | 生理的変化 | DBPへの影響 |
|---|---|---|
| 大動脈の弾性低下 | 拡張期の貯蔵血流が減少 | DBP低下 |
| 反射波の早期帰還 | 拡張期補強が消失 | DBP低下 |
| 血流伝播の非効率化 | 末梢への血流供給減少 | DBP低下 |
| 拡張期灌流の不全 | 心筋・腎・脳の虚血リスク上昇 | 臨床的悪化 |
家庭血圧で「DBP低下」をどう見るか?
- 朝の血圧測定で、DBPが70 mmHg未満が継続していれば、AS進行の疑いがあります。
- SBPは正常〜軽度上昇、DBPが低下→脈圧が拡大している場合は、特に注意が必要です。