はじめに
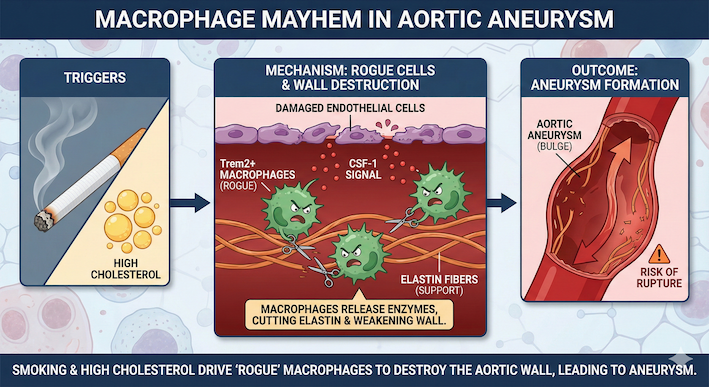
静かなる殺し屋、大動脈瘤。それは血管壁が長い時間をかけて脆弱化し、大動脈が突如として決壊、失血死へと至る最悪のシナリオを秘めた疾患です。これまで、遺伝性疾患を除けば、動脈硬化、高血圧、そして何よりも喫煙が強力なリスク因子として知られてきました。しかし、なぜ喫煙がこれほどまでに瘤の形成と破裂を加速させるのか、その具体的な細胞・分子動態は長い間、霧の中にありました。JACC誌に掲載されたMatthias Nahrendorf博士らのエディトリアルは、Thayaparanらによる研究(Nat Immunol. 2025 May;26(5):706-721.)をもとに、マクロファージが血管壁を破壊する「暴走(Mayhem)」のメカニズムを解説しています。
従来モデルの限界と、高忠実度モデルによるパラダイムシフト
医学研究において、疾患の本質を理解するためには、その再現モデルの精度が極めて重要です。従来の大動脈瘤マウスモデルでは、エラスターゼ(弾性繊維分解酵素)を大動脈に直接塗布したり、塩化カルシウムによる化学的損傷を加えたりする手法が一般的でした。しかし、これらのモデルは「開腹手術(laparotomy)」を必要とし、疾患の初期段階で起こる自然な発症プロセスをスキップしてしまうという致命的な欠陥がありました。
人間における最大のリスク因子である「喫煙」と「高コレステロール血症」を組み合わせに注目しました。Apoe欠損マウスを用い、高コレステロール食に加え、わずか4週間の煙草煙曝露を行うことで、臨床的に人間で最も頻発する部位である腹部大動脈に、偏心性の拡張を誘導することに成功しました。この曝露期間を延長すると、大動脈瘤の発生率は上昇し、約11%のマウスにおいて致死的な破裂が確認されました。これは、「肺での炎症 → 全身の免疫系の活性化 → 遠く離れた血管での破壊」という、複数の臓器が連携して病気を引き起こす一連の流れ(軸)、つまり肺・血管・免疫系が相互に作用する「臓器軸」を捉えた、極めてトランスレーショナルなモデルと言えます。
血管内皮細胞の機能不全とCSF-1の過剰放出
一酸化窒素(NO)産生低下
分子生物学的な視点から見たとき、大動脈瘤の「最初の一撃」は、血管内皮細胞の機能不全から始まります。研究データによれば、喫煙刺激を受けた大動脈組織では、一酸化窒素(NO)合成酵素の発現が著しく低下していました。NOの減少は内皮細胞のバリア機能を損なわせ、血管壁を「非粘着性の防壁」から「白血球のゲート」へと変貌させます。
CSF-1(コロニー刺激因子1)放出
この機能不全に陥った内皮細胞が放出するのが、CSF-1(コロニー刺激因子1、別名M-CSF)です。CSF-1はマクロファージの生存、増殖、そして遊走を制御する強力なサイトカインです。喫煙誘発性の内皮障害は、このCSF-1の産生をブーストし、循環血中から単球を血管壁へと強力にリクルートします。モデルを用いた運命マッピング(fate-mapping)解析によれば、大動脈壁で増殖するマクロファージの大部分は、局所の増殖よりも、この単球リクルートに由来していることが証明されました。
マクロファージの不均一性とTrem2/SPP1陽性サブセットの暗躍
単一細胞トランスクリプトーム解析(scRNA-seq)という最新の武器を用いることで、研究チームは大動脈瘤内部で暴動を起こしている犯人の正体を特定しました。喫煙曝露によって増加したマクロファージは、高度に活性化された炎症状態にありました。
特に注目すべきは、Trem2(Triggering Receptor Expressed on Myeloid cells 2)を発現し、骨橋タンパク質(SPP1/オステオポンチン Osteopontin)(※ 補足参照)を産生するマクロファージのサブセットです。Trem2とは、骨髄系細胞(マクロファージや樹状細胞など)の表面に発現するトランスメンブレン型の受容体タンパク質です。このTrem2+マクロファージは、近年、様々な臓器の病理学的変化に関与していることが認識されつつある集団ですが、大動脈瘤においてもエラスチン分解酵素(プロテアーゼ)の主要な供給源となっていることが判明しました。
組織学的解析では、中膜(tunica media)の破壊とエラスチン繊維の断片化が確認され、その損傷部位はマクロファージ密度が最も高い領域、および動脈硬化プラークに隣接する部位と正確に一致していました。これは、大動脈瘤が単なる血管の拡張ではなく、プラーク内のマクロファージが引き起こす「血管壁の侵食」であることを強く示唆しています。
マウスとヒトの共通性:種を超えた免疫経路の保存
本研究のもう一つの特筆すべき点は、マウスから得られた知見を、実際に外科的修復を受けたヒトの大動脈瘤患者のscRNA-seqデータセットとクロスリファレンス(照合)している点です。驚くべきことに、マウスのモデルで観察された単球およびマクロファージの表現型の変化は、ヒトの病態と高い一致を示しました。
適切なリスク因子(喫煙と脂質)を設定すれば、マウスの免疫経路はヒトの疾患を鏡のように映し出すことが証明されたのです。このinterspecies comparison(種間比較)の成功は、本研究で見出されたCSF-1依存的な経路が、ヒトにおける治療標的としても極めて有望であることを裏付けています。実際、研究においてCSF-1受容体(CSF-1R)阻害剤を早期に投与したところ、マクロファージの蓄積が抑制され、中膜の破壊が軽減し、大動脈瘤の形成が完全に阻止されました。
明日から実践すべきこと
この論文が提示する科学的事実は、単なる知識として留めるべきではなく、具体的な行動変容へとつなげるべき情報を含んでいます。
第一に、喫煙の「しきい値」に関する認識です。このモデルでは、わずか4週間の曝露で血管壁の不可逆的な変化が始まっていました。喫煙は血管内皮におけるNO合成を阻害し、CSF-1という「炎症の狼煙」を上げさせます。禁煙は、単に癌予防のためだけでなく、体内で最大のエラスチン貯蔵庫である大動脈を守るための最優先事項です。
第二に、高コレステロール血症の徹底的な管理です。研究では「喫煙単独」では大動脈瘤の形成には至らず、高脂血症が必須の共同因子となっていました。脂質代謝の異常は、単球の供給源を拡大させ、マクロファージの表現型をより攻撃的なものへとシフトさせます。LDLコレステロールの管理は、動脈硬化の予防のみならず、マクロファージの「暴走」を抑え込むための兵糧攻めとして機能します。
第三に、内皮機能の維持です。NO合成酵素の低下が発症のトリガーであるならば、内皮機能を保護する生活習慣(適度な運動、抗酸化物質を含む食事、血圧管理)は、CSF-1の過剰放出を防ぐための分子レベルの防衛策となります。
本研究の限界(Limitation)
科学的誠実さに基づき、本研究の限界についても触れる必要があります。
まず、喫煙曝露モデルは極めて高い忠実度を誇る反面、技術的な要求水準が高く、長期間の曝露維持には多大なコストと管理を要します。また、本研究ではCSF-1R阻害剤の早期介入による「予防」効果は示されましたが、すでに瘤が形成された後、あるいは破裂寸前の状態における「治療・逆転」効果についてはさらなる検証が必要です。
さらに、喫煙に含まれる数千種類の化学物質のうち、具体的にどの成分がNO合成酵素の低下とCSF-1の亢進に最も寄与しているのか、その詳細な化学的トリガーの特定は今後の課題として残されています。また、マウスの11%という破裂率はヒトの臨床データと比較して解析の余地があり、個体差を生む遺伝的・環境的背景の解明も待たれるところです。
結論
本研究は、大動脈瘤という疾患の捉え方を根本から変えました。瘤は単に物理的な圧力が原因で膨らむのではなく、内皮細胞が発する悲鳴(CSF-1)に応答したマクロファージが、自らの足場である血管壁を食い破ることで発生する「能動的な破壊プロセス」です。
私たちが明日から行うべきことは、この分子レベルの反乱を未然に防ぐことです。血管内皮を健やかに保ち、マクロファージに暴走の機会を与えない。これこそが我々が守るべきシンプルな原則なのです。
参考文献
Nahrendorf, M., & Robbins, C. (2025). Macrophage Mayhem in Aortic Aneurysm. JACC: Basic to Translational Science, 10(12), 101432. https://doi.org/10.1016/j.jacbts.2025.101432
補足:骨橋タンパク質(SPP1/オステオポンチン Osteopontin)とは
骨橋タンパク質、一般的にオステオポンチン(Osteopontin, OPN)と呼ばれるこの分子は、今回の論文の文脈において、大動脈瘤を悪化させる「暴走マクロファージ」の性質を決定づける重要な鍵となるタンパク質です。遺伝子名はSPP1(Secreted Phosphoprotein 1:分泌型リン酸化タンパク質1)です。
オステオポンチン(SPP1)の正体:多機能な「接着剤」兼「信号弾」
その名前が示す通り、「骨(Osteo)の橋渡し(Pontin)」をするタンパク質として最初に骨組織で発見されました。カルシウムと結合し、骨を作る細胞を骨の基質に接着させる役割を持っています。
しかし、その後の研究で、このタンパク質が骨だけでなく、免疫細胞、腎臓、平滑筋細胞など、全身の様々な細胞で作られていることが判明しました。現在では、単なる構造材ではなく、強力な生理活性を持つ多機能タンパク質(サイトカインの一種)として認識されています。
主な働きは以下の2点に集約されます。
- 細胞接着の仲介(分子の糊):細胞表面にあるインテグリンやCD44といった受容体に結合し、細胞を周囲の組織(細胞外基質)や他の細胞に「接着」させる役割を果たします。
- 炎症の促進(信号弾):免疫細胞(特にマクロファージやT細胞)を炎症部位に呼び寄せる「遊走因子(ケモカイン)」として働き、さらにそれらの細胞を活性化させて生存期間を延ばす、強力な炎症促進シグナルを出します。
大動脈瘤におけるSPP1の「悪役」としての役割
今回の論文の文脈では、SPP1は血管壁を破壊する「暴走マクロファージ(Trem2陽性マクロファージ)」が大量に産生する物質として特定されました。
正常な組織修復の過程では、SPP1は傷口を治すために必要な免疫細胞を呼ぶ「良い役割」を果たします。しかし、喫煙や高コレステロールによって慢性的な炎症が続く大動脈瘤の環境下では、SPP1の産生が過剰になり、炎症の悪循環(Mayhem/暴走)を引き起こす燃料となってしまいます。
具体的には、大動脈瘤の病変部で以下のような悪さをしていると考えられます。
- 破壊部隊の動員と定着:暴走マクロファージが放出するSPP1が信号弾となり、血液中からさらに多くの単球(マクロファージの予備軍)を血管壁の損傷部位に呼び寄せます。さらに、その「糊」としての性質により、呼び寄せた細胞をその場に強く定着させます。
- 炎症の慢性化:SPP1はマクロファージのアポトーシス(細胞死)を抑制し、寿命を延ばす働きがあります。これにより、血管壁を破壊する細胞がいつまでも居座り続け、炎症が終息せずに慢性化します。
- 血管の石灰化との関連:SPP1はカルシウムと結合しやすいため、動脈硬化プラークの石灰化(血管が骨のように硬くなる現象)にも深く関与しています。これは血管のしなやかさを奪い、破裂のリスクを高める要因の一つとなります。
補足のまとめ
オステオポンチン(SPP1)とは、大動脈瘤の現場において、暴走したマクロファージが周囲の組織に接着し、さらに仲間を呼び寄せて炎症の炎を燃え上がらせるために使う「強力な武器(炎症性サイトカイン)」と言えます。
この論文において「Trem2+/SPP1+ マクロファージ」が特定されたことは、「血管壁を破壊している真犯人の細胞は、このタンパク質を大量に出して暴れている集団である」ということを分子レベルで突き止めた、非常に重要な意味を持っています。