アジアを襲う「静かなるパンデミック」の正体とパラドックス
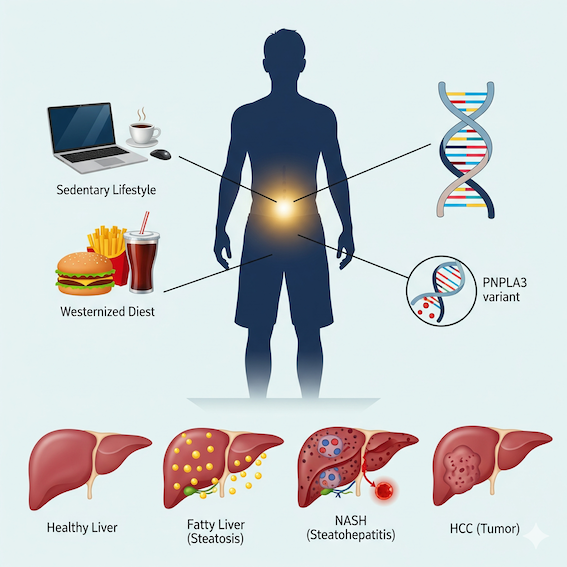
かつて過栄養に関連する疾患は西洋諸国の象徴とされてきましたが、過去20年間におけるアジアの都市化、身体活動の低下、あるいは食生活の欧米化は、この地域の疾病構造を根底から覆しました。現在、アジアにおける非アルコール性脂肪性肝疾患(NAFLD)の有病率は約27.4パーセントに達しており、これは多くの西洋諸国と同等の水準です。
しかし、アジアにおけるこの流行には特有のパラドックスが存在します。それは、西洋人に比べて著しく低いBMI(体格指数)であっても、2型糖尿病や心血管疾患、あるいはNAFLDを発症するという事実です。世界保健機関(WHO)の基準ではBMI 25キログラム毎平方メートル以上が過体重とされますが、多くのアジア人においては、BMIが22から25の範囲であっても代謝疾患のリスクが顕著に上昇し、26から31の範囲ですでに高リスク群に分類されることが指摘されています。この背景には、アジア人が低いBMIであっても内臓脂肪が蓄積しやすい「中心性肥満」の表現型を有しているという解剖学的な特徴が深く関わっています。
PNPLA3遺伝子とアジア人の遺伝的脆弱性
本論文が提示する最も注目すべき学術的知見の一つは、NAFLDの発症と進展における遺伝的背景の寄与です。特に、パタチン様ホスホリパーゼドメイン含有タンパク質3(Patatin-like phospholipase domain-containing 3;PNPLA3)のrs738409遺伝子多型は、肝細胞内でのトリグリセリドの加水分解を阻害し、脂肪蓄積を促進する鍵因子として同定されています。
驚くべきことに、このリスクに関連するGG遺伝子型は、白人の約4パーセント、アフリカ系アメリカ人の約2パーセントに過ぎないのに対し、多くのアジア人集団では13パーセントから19パーセントという極めて高い頻度で保持されています。この遺伝的な脆弱性が、アジア人が西洋人ほどの肥満を呈さずとも重度の脂肪肝を発症しやすい理由の一端を説明しています。
また、TM6SF2遺伝子の変異や、高トリグリセリド血症や冠動脈疾患との関連が示唆されるAPOC3遺伝子多型の関与も議論されています。ある研究では、正常体重のインド人男性のうちAPOC3変異を有する者の38パーセントがNAFLDを呈し、顕著なインスリン抵抗性を示したというデータがあり、代謝プロファイルと遺伝的背景の複雑な相互作用が浮き彫りになっています。
非肥満型NAFLDという新たな脅威
アジアにおいて特に警戒すべきは、BMIが25未満でありながらNAFLDを発症する「非肥満型(Non-obese/Lean)NAFLD」の存在です。全人口のスクリーニングにおいて、BMIが正常範囲にあるアジア人の8パーセントから19パーセントがNAFLDと診断されています。
これらの症例は、一見すると健康的な体格に見えますが、実際には中心性肥満、インスリン抵抗性、脂質異常症あるいは高血圧といった代謝的な問題を抱えていることが少なくありません。分子生物学的な解析によれば、非肥満型NAFLD患者ではリゾホスファチジルコリンやホスファチジルコリンの代謝変動が見られ、肥満型とは異なる、あるいはより先鋭化された病態生理が存在する可能性が示唆されています。また、若年成人期からの急激な体重増加やウエスト周囲径の増大が、BMIが正常範囲内であっても発症の強力な予測因子となることが示されています。
サルコペニアと肝臓:筋肉量という防御因子
本論文は、骨格筋と肝臓の代謝的なクロストークにも焦点を当てています。骨格筋はインスリンを介したグルコース利用の主要な臓器ですが、加齢や運動不足に伴う骨格筋量の低下、すなわち「サルコペニア」は、肥満やインスリン抵抗性とは独立してNAFLDや肝線維化の進行と相関することが韓国や日本からの報告で明らかになっています。
骨格筋量の維持は、全身のインスリン感受性を保つ上で不可欠であり、筋肉量の減少が肝臓への脂肪流入を加速させるというメカニズムは、インテリジェンスの高い読者が注目すべき新しい代謝軸です。
自然経過と肝細胞がんの特異的動態
NAFLDの自然経過に関して、アジアのデータは非常に示唆に富んでいます。単純脂肪肝から非アルコール性脂肪肝炎(NASH)への進行は、3年間で約25パーセントの患者に見られ、肝線維化はNASH患者で平均7年に1ステージ、単純脂肪肝でも14年に1ステージ進行します。
特筆すべきは肝細胞がん(HCC)の発症様式です。西洋では肝硬変を経てHCCに至るのが一般的ですが、アジアのNAFLD患者では、肝硬変を伴わない状態でのHCC発症が30パーセントから50パーセントという高い割合で報告されています。糖尿病の併存や、非侵襲的線維化マーカーであるAPRI(AST-to-Platelet Ratio Index)が1.5以上であることが、非肝硬変例におけるHCCリスクの指標として提示されています。
B型肝炎ウイルスとの複雑な相互作用
アジアにおいて避けて通れないのが、B型肝炎ウイルス(HBV)との共感染の問題です。アジアのHBV患者における脂肪肝の有病率は14パーセントから67パーセントに及びます。興味深いことに、HBV感染自体がNAFLDの発症に対して保護的に働く可能性を示唆する疫学データがある一方、一度メタボリックシンドロームや脂肪肝を併発すると、肝硬変やHCCへのリスクは相乗的に高まります。台湾の研究では、HBV感染に糖尿病と肥満が組み合わさった場合、HCCの発症リスクは12.8倍にまで跳ね上がることが示されており、ウイルス制御と代謝管理の双方が不可欠であることを物語っています。
本研究の新規性と学術的意義
本論文の新規性は、2009年以降に蓄積されたアジア独自の膨大な疫学的・遺伝学的データを統合し、西洋の知見をそのまま適用できないアジア人固有のNAFLDフェノタイプを明確に定義した点にあります。特に、PNPLA3遺伝子多型のアジアにおける高い浸透率と、非肥満型NAFLDの臨床的重要性を強調したことは、世界的なガイドラインの構築に大きな影響を与えるものです。また、骨格筋量や生活習慣病と肝細胞がん発症の関係を多角的に分析し、アジア特有のリスク階層化モデルを提示した点も極めて高い学術的価値を有しています。
臨床的・実践的提言:明日から実践すべき管理戦略
本論文の知見を日常生活や臨床実践に活かすためには、以下の戦略が重要となります。
第一に、減量のターゲット設定です。肝臓内の脂肪含有量を減少させ、NASHの解像を目指すには、体重の7パーセントから10パーセントの減少が最も効果的です。ただし、アジア人ではわずか3パーセントから5パーセントの減量であっても、肝機能の改善が見られるケースが多いことも示されています。
第二に、運動の質です。有酸素運動とレジスタンス運動(筋トレ)の双方が肝脂肪の減少に有効です。特にサルコペニアの予防を念頭に置いた筋力の維持は、長期的な代謝の安定に寄与します。
第三に、食事の質の再考です。野菜や魚を中心とした伝統的なアジアの食事パターンへの回帰、および果糖を多く含む飲料や赤身肉の摂取抑制が推奨されています。特に非肥満型の方であっても、若年時からの体重変化や腹囲の増大には細心の注意を払うべきです。
限界(Limitation)と今後の課題
本研究にもいくつかの限界が存在します。第一に、NAFLDの薬物治療に関する大規模な臨床試験において、アジア人患者のデータが依然として不足している点です。ビタミンEやピオグリタゾンの効果については限定的なデータしか存在せず、アジア人の遺伝的特性に最適化された治療法の確立が待たれます。
第二に、アジア内の多様性です。アジアは広大であり、生活様式や遺伝的背景は国によって異なります。例えば、肥満率はティモール・レステの1パーセントからカタールの34パーセントまで大きな幅があり、これら全ての国々に一律の基準を適用することの難しさが残されています。また、多くの研究が後方視的であるため、長期的な予後を確定させるためには、さらに大規模な前方視的コホート研究が必要です。
結論
アジアにおけるNAFLDは、もはや単なる「肝臓の病気」ではなく、遺伝的背景と急速な環境変化が交差する「全身性の代謝パンデミック」として捉えるべきです。低BMIであってもリスクを軽視せず、PNPLA3に代表される遺伝的脆弱性を認識し、筋肉量の維持と適切な体重管理を行うことが、将来的な肝不全や肝がんを防ぐための最良の手段です。本論文が示すデータに基づき、自らの代謝プロファイルを正しく評価し、予防医学的なアプローチを実践することが、知識ある市民に求められる現代の健康戦略と言えるでしょう。
参考文献
Fan, J. G., Kim, S. U., & Wong, V. W. (2017). New trends on obesity and NAFLD in Asia. Journal of hepatology, 67(4), 862-873.